

Protein & Cell:曾坚阳/李丕龙团队合作提出基于相分离的新冠联合用药新策略
日期:2021-04-07 浏览次数:9327
来源:BioArt
2021年3月26日,清华大学交叉信息研究院曾坚阳课题组与清华大学生命科学学院李丕龙课题组合作在Protein & Cell在线发表题为 Understanding the phase separation characteristics of nucleocapsid protein provides a new therapeutic opportunity against SARS-CoV-2 的研究【4】,该研究在SARS-CoV-2 N蛋白能自发相分离的基础上,进一步探究了病毒RNA及复制相关蛋白参与N蛋白分相的情况,并结合前期大数据筛选结果【5】,发现了两个靶向N蛋白的小分子药物可以特异性干预N-viral RNA-nsp12复合物的相分离特性,进而提高其他抗病毒药物进入靶点的效率,最终提出基于相分离的抗病毒药物联合使用新策略。
研究人员首先通过IUPred2和PLAAC预测了N蛋白发生相分离的结构特性,并通过体外重构证实了其自身发生相分离的能力。进一步的体外相变实验表明,N蛋白与病毒特有序列UCUAA表现出较高的结合亲和力,从而形成更为稳定的相分离液滴,而完整的N蛋白结构对于其相分离也是至关重要的。此外,研究人员还通过体外实验证明了目前N蛋白上累积产生的部分高频突变也会影响N蛋白的相分离特性。
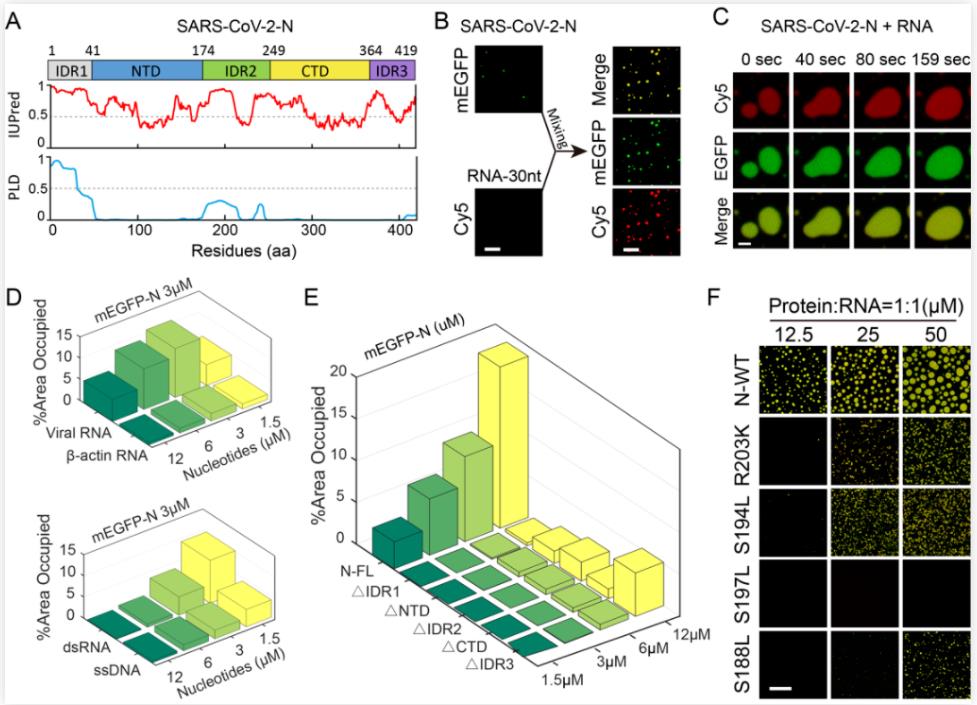
图1. SARS-CoV-2 N蛋白相分离特性的鉴定
已知SARS-CoV-2的复制是由Nsps蛋白为主的多亚基复制/转录复合物(RTC)共同介导的,而该复合物的核心组分是RNA依赖型RNA聚合酶 (RdRp)的催化亚基(nsp12),也是极为重要的病毒靶点之一。值得注意的是,N蛋白是目前唯一已知能自由穿梭病毒“复制工厂”并促进病毒RNA转录和复制的结构蛋白。研究者发现单独的nsp12蛋白在体外不能形成相分离,但它却能被招募进N蛋白驱动的相分离液滴中,且体外重构的RdRp复合物(nsp12-nsp7-nsp8)也能被招募其中,这为N蛋白参与病毒转录、复制提供了依据。
此外,研究人员前期基于人工智能的药物重定位框架筛选到了特异性靶向N蛋白的两个小分子(CVL218和PJ34)【5】,体外实验证明CVL218和PJ34的加入会影响N-viral RNA-nsp12复合物的液滴大小及其内部流动性。研究人员猜测这一药物处理后“疏松”的液滴状态,可能会增加靶向nsp12蛋白的小分子(如瑞德西韦)对其靶点的可及性。随后,研究人员与其合作团队在细胞层面进行了活毒侵染实验,结果表明CVL218和瑞德西韦联合用药组在抗病毒效果上的确优于瑞德西韦单独用药组,一定程度上证明了上述假设。
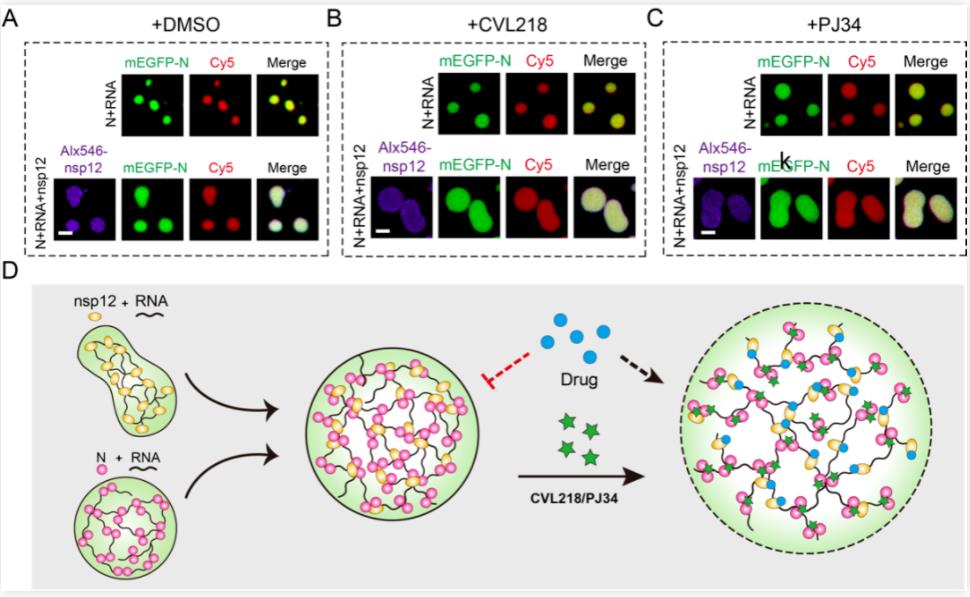
综上所述,本研究系统性鉴定了SARS-CoV-2 N蛋白的相分离特性,首次发现靶向N蛋白的小分子CVL218和PJ34能够干预N-viral RNA-nsp12复合物的液滴形态及内部流动性,有效提高其他小分子药物进入病毒靶蛋白的效率,为后续新冠肺炎的治疗提出了基于相分离机制的联合用药新策略。
据悉,清华大学交叉信息研究院曾坚阳副教授与清华大学生命科学学院李丕龙研究员为本文的共同通讯作者;清华大学交叉信息研究院助理研究员赵诞、清华大学生命科学学院博士后许伟凡、清华大学交叉信息研究院博士后张晓凡为本文的共同第一作者。本研究还得到了清华大学医学院李海涛教授、江苏省疾病预防控制中心朱凤才教授团队、甫康(上海)健康科技有限公司沈孝坤博士、清华大学蛋白制备与鉴定平台、清华大学药学技术中心活性筛选平台的大力支持。
原文链接:https://link.springer.com/article/10.1007/s13238-021-00832-z
参考文献: