

CRISPR,NgAgo之外的新型基因编辑技术——南京大学报道SGN
日期:2016-09-22 浏览次数:8616
在生物学的基础研究、基因治疗和遗传改良上常常需要对目标基因进行“编辑”,即对特定DNA片断进行删除、插入、替换等操作。近年来基因编辑技术的发展可谓突飞猛进,继ZFN(锌指核酸内切酶),TALEN(类转录激活因子效应物核酸酶)后出现的CRISPR/Cas9(规律性间隔的短回文序列重复簇),因其成本低、简便、高效等优点,已迅速风靡于世界各地,张锋(博德研究所),Jennifer Doudna(加州大学伯克利分校)和EmmanuelleCharpentier(德国亥姆霍兹传染研究中心)也因发展CRISPR-Cas应用于真核细胞上的努力和贡献,于2016年3月荣获加拿大盖尔德纳奖。在9月21日汤森路透发布的“2016年引文桂冠奖(CitationLaureates)”名单中,1982年出生于河北石家庄的张锋更是榜上有名http://www.thomsonscientific.com.cn/press/press20160921/,该名单因成功预测多位诺贝尔奖得主而闻名。
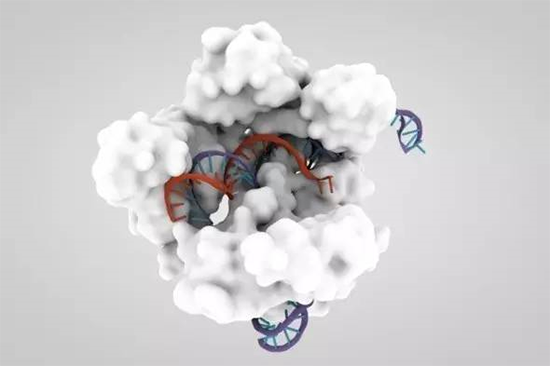
CRISPR/Cas9的三维模型(HAOJIANG, Getty Images)
和其他任何一项技术一样,CRISPR-Cas也有它的局限性。因此科学家们一方面致力于在CRISPR基础上进行改良[1]:比如从金黄色葡萄球菌里提取mini-Cas9来代替Cas9[2],以解决因Cas9酶和RNA链的组合过于庞大而不能进入用于基因治疗的病毒内部这一问题;或者用失活的Cas9绑定另外一种酶来实现特定DNA序列的改变[3],而不像之前CRISPR-Cas常被用在仅仅实现特定DNA序列的删除。在这个系统中失活的Cas9仍然能在RNA引导下定位到特定的DNA序列,而基因编辑是由绑定的另一种酶来实现;研究人员也在尝试寻找其他更多的酶,如Cpf1[4],来扩大编辑范围,因为Cas9只能在具有特定DNA序列位点的周围进行切割。
另一方面,科学家们一直在寻找新的基因编辑方法。今年5月份河北科技大学韩春雨NgAgo论文[5]的横空出世,带给领域内极大的兴奋和不小的震动,尽管目前关于该实验重复性的争论还远未烟消云散,但是用格氏嗜盐碱杆菌(Natronobacteriumgregoryi)的Argonaute蛋白,外加一段5’端磷酸化的24个碱基的单链DNA就能实现DNA引导的基因组编辑,该文章报道的结果确实为基因编辑技术的发展带来了一个崭新的思路。

Argonaute蛋白模型(Laguna Design/SPL, [1])
近日,南京大学医学院附属金陵医院的周国华教授、南京大学模式动物所的赵庆顺教授和朱敏生教授及他们的团队在Genome Biology上报道了基因编辑的又一个全新的方法[6],结构引导的核酸内切酶技术SGN(structure-guided endonuclease)。这一新方法的突破在于,不同于以往的ZFN,TALEN,CRISPR-Cas甚至NgAgo等技术,SGN不受靶标序列限制。SGN中包含识别3’flap结构的内切酶FEN-1(flapendonuclease-1)和能够切割DNA链的Fok I(Fn1)的切割结构域,人工合成的引导DNA(guide DNA)能够和靶标序列形成3’flap结构,该结构被SGN识别并结合后,SGN就可以对任何想要进行编辑的靶标DNA进行剪辑。

推测SGN产生大片段DNA删除的机制(Xu et al.,2016 [6])
在Genome Biology同期配发的Research Highlight[7]中,NIH的Shawn M Burgess教授总结了SGN的三个关键特征,1. FEN-1与FokI切割结构域形成的融合蛋白(SGN)可以通过利用DNA寡聚体(向导DNA)去靶向突变特定基因位点。2. 这种靶向突变方式倾向于产生大片段DNA的删除,删除片断可达几百至几千个碱基对。3. SGN在斑马鱼胚胎中已显示出效果,表明这种基因编辑技术在模式动物中具备可行性。Burgess教授还宣称[7],在基因编辑上,SGN是一个令人激动的新选择,因为SGN非常灵活、简便,并且具有删除大片段DNA的潜力。这对于想要通过灭活某个基因以达到基因治疗或遗传改良效果的研究者来说,无疑是一大喜讯。此外,大片段DNA删除还可以防止在研究中出现的假阴性。

本文的通讯作者。左起周国华、赵庆顺、朱敏生(图片来自官网)
相较于评论专家及领域内研究者们的兴奋,该文章的作者们却表现得相当平静。赵庆顺教授对中国生物物理学会的采访者表示,这一项新技术才刚刚起步,SGN在很多方面都需要在后续工作中不断去优化和探索,他们已准备好质粒,欢迎更多的同行参与进来,共同推进SGN的完善与应用。
参考文献:
[1] Ledford H. Beyond CRISPR: A guide to the many other ways to edit a genome. (2016) Nature 536: 136–137, DOI:10.1038/536136b
[2] Ran FA, Cong L, Yan WX, et al. In vivo genome editing using Staphylococcus aureus Cas9. (2015) Nature 520: 186—191, DOI:10.1038/nature14299
[3] Komor AC, Kim YB, Packer MS, et al. Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage. (2016) Nature 533: 420—424, DOI: 10.1038/nature17946.
[4] Kim D, Kim J, Hur JK et al.Genome-wide analysis reveals specificities of Cpf1 endonucleases in human cells.(2016) Nat Biotechnol, 34: 863—868, http://dx.doi.org/10.1038/nbt.3609
[5] Gao F, Shen XZ, Jiang F, et al. DNA-guided genome editing using the Natronobacterium gregoryi Argonaute. (2016) Nat Biotechnol 34:768—773, DOI: 10.1038/nbt.3547
[6] Xu S, Cao S, Zou B, etal. An alternative novel tool for DNA editing without target sequence limitation: the structure-guided nuclease. (2016) Genome Biol, 17: 186, DOI: 10.1186/s13059-016-1038-5
[7] Varshney GK, Burgess SM. DNA-guided genome editing using structure-guided endonucleases. (2016) Genome Biol 17:187, DOI:10.1186/s13059-016-1055-4