

PNAS〡南京大学石云研究组发现信号肽的新功能—编码谷氨酸受体的空间结构
日期:2016-09-07 浏览次数:8591
谷氨酸是大脑中最重要的一种兴奋性神经递质,它能够结合谷氨酸受体蛋白,如AMPA受体,使一些带正电的离子(如Na+,K+,Ca2 +等)进入突触后细胞,导致去极化从而激发神经元。AMPA受体的紊乱会造成学习记忆的损害,甚至导致精神疾病。
蛋白的功能与其结构密切相关,研究表明大脑中AMPA受体主要是由GluA1和GluA2两种不同的蛋白亚基组成的异源四聚体,但由于这种异源四聚体的结晶非常困难,所以GluA1和GluA亚基的配比及其空间结构这一重要问题一直没有得到阐明。

石云教授(图片来自南京大学模式动物所官网)
在9月6日南京大学石云研究组于PNAS在线发表题为“GluA1 signal peptide determines the spatial assembly of heteromeric AMPA receptors” 的文章中[1],他们以GluA2同源四聚体为模板,巧妙地利用cysteine crosslinking技术来研究各蛋白亚基之间的接触面,获得了AMPA受体异源四聚体的空间结构信息,即GluA1和GluA2亚基间是以1-2-1-2构型排列的。进一步的研究产生了令人吃惊的结果:AMPA受体的空间排列竟然是由信号肽的序列决定的。当GluA1和GluA2的信号肽被互换时,GluA1和GluA2的位置发生了交换(氨基酸的序列没有变化),空间排列变为2-1-2-1构型(更多实验表明,是GluA1而不是GluA2的信号肽在其中起了决定性作用)。 这一结果与教科书中传统上所认为的蛋白的空间结构是由其初级结构,即氨基酸序列所决定的观点不同。本文的审稿专家也认为,这是一个非常新颖而且意想不到的发现。
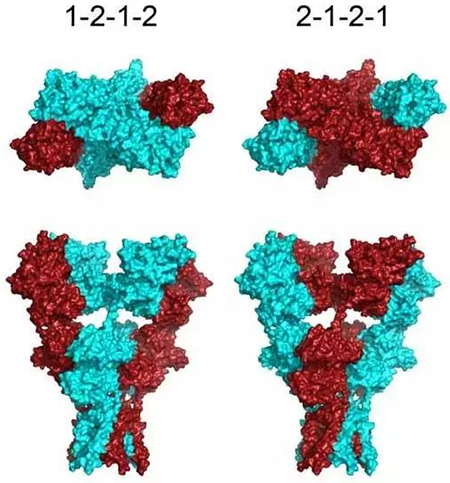
AMPA受体的空间结构(GluA1和GluA2的信号肽被互换后,空间排列由1-2-1-2(左)变为2-1-2-1构型(右)图片来自参考文献1)
对于这一研究结果背后的机制,即信号肽如何决定蛋白的空间结构,石云教授也坦承,目前还很难给出明确的答案。信号肽是位于蛋白肽链前端的20—40个氨基酸,它能够指导新生肽链的定位。一般来说,信号肽在蛋白质成熟以前就已经被信号肽酶切除掉,所以很难想象信号肽会在蛋白的空间排列上起直接的作用,一个推测是被切除后的信号肽有可能黏附在受体的亚基上或通过其他方式间接地指导谷氨酸受体的排列组装。另一种推测是GluA1信号肽的切除时间是非常特殊的,即在受体的空间结构组装好之后才被切掉,那么信号肽酶(底物识别和切割位于内质网膜上)怎样能接触并识别信号肽(据推测远离内质网膜),又成为一个难以解释的问题。
生命是如此的复杂与玄妙,我们对生命的认知程度也在随科技的发展不断被补充、更新与修正,信号肽能够编码谷氨酸受体空间信息这一新功能的发现,也许能为蛋白结构研究这一领域提供一些新的思路和可能,也可能是很多有趣新发现的一个开端。
参考文献:
1. He X, Li Y, Kalyanaraman C, et al. (2016) GluA1 signal peptidedetermines the spatial assembly of heteromeric AMPA receptors. PNAS doi:10.1073/pnas.1524358113