Protein & Cell:项耀祖团队发表SGLT2抑制剂心血管保护机制最新研究成果
日期:2021-01-27 浏览次数:11110
来源:BioArt
心血管疾病严重威胁人类健康,流行病学数据显示,我国心血管病发病率和死亡率逐年上升。糖尿病预示着心血管事件、心力衰竭及死亡的风险急剧增加,糖尿病合并心衰患者的发病率和死亡率显著提高。近年来,一种新型的钠葡萄糖共转运载体2(SGLT2)抑制剂类降糖药因其具有显著的心血管保护作用,受到广泛关注。这类药物通过抑制肾小管远端SGLT2的活性,使体内过量的葡萄糖以糖尿的形式排除体外,从而达到降低血糖的作用。然而大量的临床试验数据表明,该类药物在降低血糖的同时,显著降低糖尿病患者的心血管病死亡率和心衰入院率,但SGLT2 抑制剂发挥心脏保护作用的分子机制仍不是很清楚。
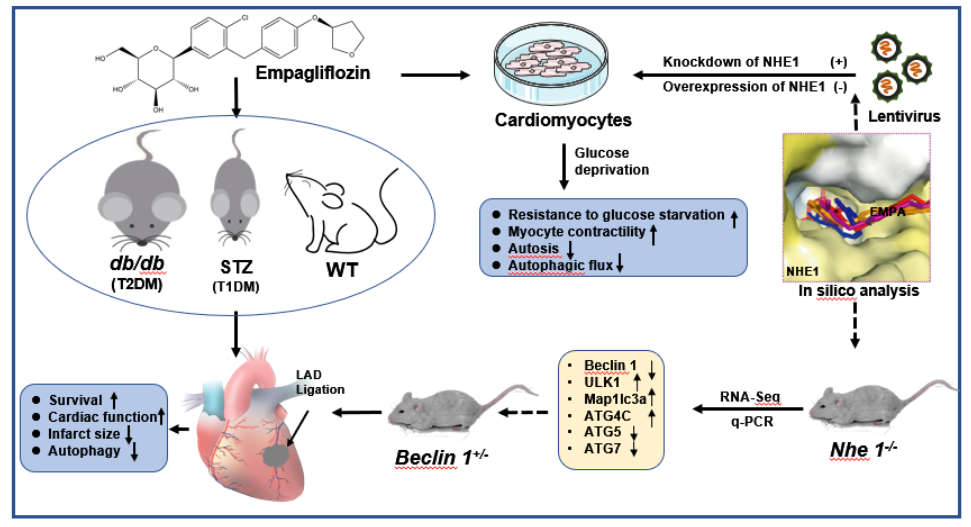
近日,来自同济大学生命学科与技术学院的项耀祖教授团队在Protein & Cell杂志上在线发表了一篇题为“Cardioprotective mechanism of SGLT2 inhibitor against myocardial infarction is through reduction of autosis”的研究论文。这项工作通过多种敲除小鼠心肌梗死(Myocardial Infarction,MI)模型、优化多种给药方式、结合生物信息学,通过体内外实验揭示了SGLT2抑制剂Empagliflozin(EMPA)作用于病理状态下心肌细胞膜蛋白钠氢共转运载体NHE1,在一定程度上调控心肌细胞内部由于过度自噬引起的自噬性死亡,从而为该药物在糖尿病或非糖尿病患者中的使用提供理论依据和实验证据。
为解决这一问题,项耀祖课题组首先在糖尿病小鼠上重现了心脏保护作用,采用db/db小鼠和STZ诱导I型糖尿病小鼠永久心梗模型,发现EMPA可以显著改善小鼠心梗后的生存率、心室功能、心脏纤维化程度,并降低心梗边缘区的心肌细胞肥大。其次,将EMPA的适用范围进一步拓展到WT小鼠心梗模型中,在非糖尿病小鼠心梗模型上,发现该类药物并不会引起血糖的显著波动,却仍具有显著心脏保护作用。作者进一步在不同来源的心肌细胞上利用葡萄糖剥夺(Glucose Deprivation,GD)模型测试EMPA及其代谢产物,揭示EMPA可以直接作用于心肌细胞,改善GD诱导的细胞自噬性死亡及心肌细胞跳动强度。随后,作者通过高效液相色谱检测EMPA在心肌细胞上的分布范围,揭示EMPA主要富集在心肌细胞细胞膜上。利用膜蛋白小分子抑制剂库筛选及蛋白晶体结构对接预测,表明EMPA可能通过与心肌细胞膜NHE1蛋白直接作用,进而发挥心脏保护作用。利用NHE1的抑制剂Cariporide在药理层面作用于同一细胞模型,表明与EMPA具有相同的心肌细胞保护作用。同时发现,EMPA能够通过抑制NHE1活性而影响胞内Na+、H+、Ca2+的水平。通过细胞水平敲低和过表达NHE1,也进一步证明NHE1是EMPA作用于心肌细胞的主要靶点。为进一步探究EMPA作用于心肌细胞的机制,作者通过转录组测序和生信分析,发现NHE1敲除小鼠较正常鼠的部分自噬通路关键基因有明显差异。因此,在细胞水平上,作者利用自噬标记蛋白LC3,以及LC3双标腺病毒检测,揭示EMPA在GD模型中的心肌保护作用是通过下调自噬通量来实现的。而且,在WT小鼠MI模型中发现:与对照组相比,EMPA可以降低心脏梗死边缘区自噬程度。同时,自噬通路关键蛋白beclin1同样也下调。于是,作者在beclin1+/-小鼠模型上建立MI模型,结果表明,小鼠心梗后的生存率提高、纤维化程度降低,同时心脏组织边缘区自噬水平下调。
综上,这项工作揭示了SGLT2抑制剂通过调控心肌细胞适度自噬挽救心肌细胞死亡的分子机制,为心梗后心衰的药物靶标发现和干预机制提供了新的见解。
同济大学生命科学与技术学院博士生姜凯、徐越为文章共同第一作者,同济大学生命科学与技术学院项耀祖教授为本文的通讯作者。
原文链接:
https://doi.org/10.1007/s13238-020-00809-4