

陈雷课题组报道人源DUOX1复合体的高分辨率结构
日期:2021-01-11 浏览次数:13783
供稿:陈雷课题组
ROS(活性氧)是化学反应活性很高,并且以氧元素为主的一系列化合物,包括过氧化氢、超氧阴离子等,它们参与众多生物学过程,同时也是一种重要的信号分子[1]。在生物体内,有很多氧化还原反应可以作为副产物产生ROS,比如线粒体呼吸链和P450氧化还原酶等。除此之外,还有一种专门产生ROS的酶即NADPH氧化酶(NOX),能够受细胞信号转导等过程的调控来产生ROS。人源NOX蛋白家族成员包括NOX1-5和DUOX1-2 [2]。NOX参与了宿主防御、分化、发育、细胞生长和存活、细胞骨架的再重建等一系列重要的生物学过程[2], [3]。DUOX1-2在甲状腺中高表达,它们能够催化氧气的还原,产生过氧化氢,进一步促进甲状腺激素的合成[4]。DUOX功能缺失性突变会导致先天性甲状腺功能减低症[5]。
NOX家族蛋白是膜整合蛋白,它们都有一个相似的核心模块,负责催化氧化还原反应,该模块由双血红素分子结合的跨膜区(TMD)和胞内的脱氢酶结构域组成[6]。而除催化核心模块外,DUOX蛋白还有一个过氧化物酶同源结构域PHD和两个EF-hand结构域。此外,DUOX蛋白还需要DUOXA1辅助亚基来形成有功能的复合物[7]。据研究报道DUOX的活力受到体内钙离子浓度的调控,钙离子可以直接结合在DUOX上,提高DUOX的酶活力[4]。尽管DUOX和其它NOX家族蛋白有着极其重要的功能,但DUOX复合体的组装以及钙激活的分子机制仍不清楚。
2021年1月8日,北京大学未来技术学院分子医学所,北大-清华生命科学联合中心陈雷研究组在Nature Communications杂志上报导了人源DUOX1复合体在高钙和低钙状态下的两个高分辨结构。
作者们首先通过凝胶过滤层析法确定人源DUOX1-DUOXA1可以形成稳定的异源四聚体复合物,然后通过体外活力测定的方法发现:在低钙条件下,DUOX1复合物显示了低的基础活力,钙离子的加入不仅能够提高DUOX复合物与底物NADPH的结合亲和力,还能提高DUOX1复合物的催化效率,从而增强了酶的活力。接着,作者们将纯化好的DUOX1复合物重构到peptidisc中,制备了高钙和低钙状态下DUOX1复合物的冷冻电镜样品。在克服了样品制备、数据处理等困难后,通过单颗粒冷冻电镜技术获得了2.6 Å和2.7 Å高分辨率的DUOX1复合体的电子密度并搭建了原子模型。
结构显示两个DUOX1亚基和两个DUOXA1亚基共同组装成一个2:2的异源四聚体复合物(图1)。整个复合物结构分为三个部分:胞外区、跨膜区和胞内区。在胞外区,位于对角线上的两个PHD结构域具有相互作用,同时DUOXA1的胞外区域从底部协助胞外区的排列;其跨膜区由24根跨膜螺旋组成,结合两对血红素,能使电子穿过细胞膜;其胞内区由起催化作用的脱氢酶结构域DH和感应钙离子的EF-hand等结构域组成。
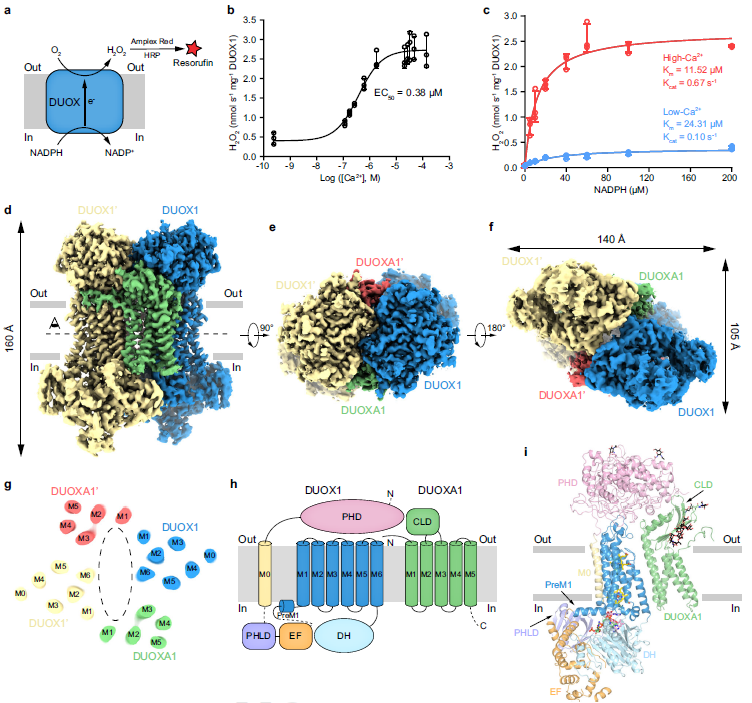
人源DUOX1-DUOXA1复合体在高钙状态下的结构
作者测量了在高钙状态下DUOX1结构中负责电子传递的各分子边缘距离,发现NADPH-FAD-内血红素-外血红素间的距离分别是8.2 Å、3.9 Å和 6.7 Å。尽管可能还有其它额外的DUOX1氨基酸残基参与了电子传递,NADPH-FAD的距离却是大于经典的FNR同源蛋白[8]。通过结构比较,作者发现与FNR以及csNOX5的DH相比,DUOX1的催化脱氢酶DH处于一个松弛的构象,因此在现有的DUOX1结构中,电子传递途径并非最优的状态。作者发现在细胞膜上的DUOX1比纯化组装在peptidisc中的样品具有更高的活力,因此推测细胞膜上的磷脂或者脂双层环境可能以某种未知的方式影响DUOX1的结构,并增强其电子传递效应。
单颗粒重构算法Multibody修正所提供的柔性分析显示在低钙状态下胞内区域显示了宽的梯形分布,这与在高钙状态下的近似正态分布形成了鲜明对比。这表明在低钙状态下胞内区具有更大的不稳定性。作者比较了高钙和低钙两个状态下的结构,发现钙引起的构象变化主要发生在胞内区的调控结构域:在低钙条件下,EF-hand调控元件呈延伸的形状;EF2远离催化DH结构域;PHLD远离TMD和DH结构域。这些结构改变使得DH与TMD的相互作用变弱,进而导致DH处于更灵活的状态。作者推测DH的高灵活性降低了电子传递的有效性和NADPH的亲和力,进而降低了DUOX的催化活力。
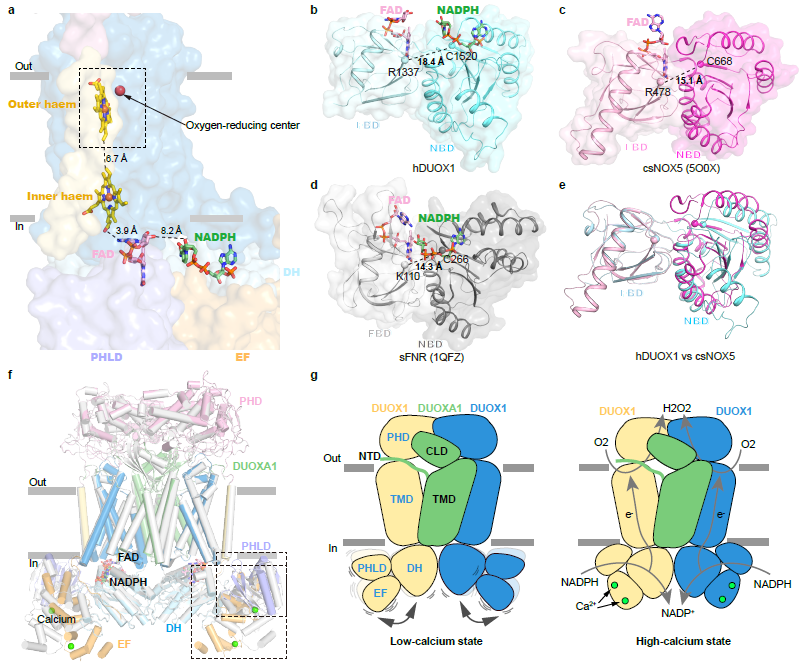
DUOX1的电子传递途径以及可能的钙激活机制
综上所述,本项研究解析了在高钙和低钙两种状态下人源DUOX1-DUOXA1在peptidisc中稳定的异源四聚体复合物的高分辨结构,观测到了高钙状态下DUOX1多个胞内结构域间的相互作用以及不同钙离子浓度下胞内调控结构域的构象变化,为深入理解DUOX以及其他NOX家族蛋白酶的结构以及活力调控机制奠定了基础。
本项研究主要由北京大学未来技术学院分子医学所博士后吴惊香完成,博士生刘锐和宋康成参与了部分实验,陈雷研究员为通讯作者。本工作获得科技部重点研发计划、国家自然科学基金委、生命科学联合中心等经费支持。博士后吴惊香获得了CLS博士后奖学金、北京大学博雅博士后奖学金、国家自然科学基金及中国博士后科学基金的支持。该工作的冷冻电镜样品制备、筛选和采集在北京大学冷冻电镜平台和北京大学电镜室完成,得到了李雪梅、郭振玺、邵博、裴霞和王国鹏等人的帮助。该项目的数据处理获得了北京大学CLS计算平台及未名超算平台的硬件和技术支持。
文章链接:
https://www.doi.org/10.1038/s41467-020-20466-9
[1] Sies H, Jones D P. Reactive oxygen species (ROS) as pleiotropic physiological signalling agents. Nat Rev Mol Cell Biol, 2020, 21(7): 363-383.
[2] Lambeth J D, Neish A S. Nox enzymes and new thinking on reactive oxygen: a double-edged sword revisited. Annu Rev Pathol, 2014, 9(119-145.
[3] Winterbourn C C, Kettle A J, Hampton M B. Reactive Oxygen Species and Neutrophil Function. Annu Rev Biochem, 2016, 85(765-792.
[4] Ohye H, Sugawara M. Dual oxidase, hydrogen peroxide and thyroid diseases. Exp Biol Med (Maywood), 2010, 235(4): 424-433.
[5] Weber G, Rabbiosi S, Zamproni I, Fugazzola L. Genetic defects of hydrogen peroxide generation in the thyroid gland. J Endocrinol Invest, 2013, 36(4): 261-266.
[6] Sumimoto H. Structure, regulation and evolution of Nox-family NADPH oxidases that produce reactive oxygen species. FEBS J, 2008, 275(13): 3249-3277.
[7] Grasberger H, Refetoff S. Identification of the maturation factor for dual oxidase. Evolution of an eukaryotic operon equivalent. J Biol Chem, 2006, 281(27): 18269-18272.
[8] Deng Z, Aliverti A, Zanetti G, Arakaki A K, Ottado J, Orellano E G, Calcaterra N B, Ceccarelli E A, Carrillo N, Karplus P A. A productive NADP+ binding mode of ferredoxin-NADP + reductase revealed by protein engineering and crystallographic studies. Nat Struct Biol, 1999, 6(9): 847-853.
[9] Li N, Wu J X, Ding D, Cheng J, Gao N, Chen L. Structure of a Pancreatic ATP-Sensitive Potassium Channel. Cell, 2017, 168(1-2): 101-110 e110.
[10] Wu J X, Ding D, Wang M, Kang Y, Zeng X, Chen L. Ligand binding and conformational changes of SUR1 subunit in pancreatic ATP-sensitive potassium channels. Protein Cell, 2018, 9(6): 553-567.
[11] Ding D, Wang M, Wu J X, Kang Y, Chen L. The Structural Basis for the Binding of Repaglinide to the Pancreatic KATP Channel. Cell Rep, 2019, 27(6): 1848-1857 e1844.
[12] Tang Q, Guo W, Zheng L, Wu J X, Liu M, Zhou X, Zhang X, Chen L. Structure of the receptor-activated human TRPC6 and TRPC3 ion channels. Cell Res, 2018,
[13] Zhang M, Wang D, Kang Y, Wu J X, Yao F, Pan C, Yan Z, Song C, Chen L. Structure of the mechanosensitive OSCA channels. Nat Struct Mol Biol, 2018, 25(9): 850-858.
[14] Kang Y L, Liu R, Wu J X, Chen L. Structural insights into the mechanism of human soluble guanylate cyclase. Nature, 2019, 574(7777): 206-+.
[15] Guan C C, Niu Y G, Chen S C, Kang Y, Wu J X, Nishi K, Chang C C Y, Chang T Y, Luo T P, Chen L. Structural insights into the inhibition mechanism of human sterol O-acyltransferase 1 by a competitive inhibitor. Nature Communications, 2020, 11(1):
[16] Kang Y, Wu J X, Chen L. Structure of voltage-modulated sodium-selective NALCN-FAM155A channel complex. Nat Commun, 2020, 11(1): 6199.