北大肖瑞平团队揭示高糖抑制AMPK信号通路的分子机制
日期:2021-01-07 浏览次数:13494
来源:Bio生物世界
在生物体内,细胞能通过感知营养物质,激活下游一系列生物学反应,从而调节机体的物质与能量平衡。其中,AMPK是调节生物能量代谢的核心分子之一,也是治疗代谢疾病的重要靶点。AMPK能感知细胞代谢状况——在营养和能量水平较低的状态下,AMPK被激活,从而抑制合成代谢、促进分解代谢,在促进ATP合成的同时抑制细胞的生长,最终维持细胞内能量稳态。另一方面,对于抑制AMPK活性的负调节机制,我们却知之甚少,也因此缺乏对于AMPK信号通路调控方式的全面认识。研究能量过剩如何抑制AMPK信号通路,不仅能够帮助我们全面了解AMPK信号通路的调控,而且对于探寻肥胖、2型糖尿病等代谢疾病的分子机制和治疗策略具有重要意义。2021年1月4日,北京大学未来技术学院肖瑞平课题组在 Cell 子刊 Molecular Cell 杂志在线发表了题为:Negative Regulation of AMPK Signaling by High Glucose via E3 Ubiquitin Ligase MG53 的研究论文。该研究揭示了高糖抑制AMPK活性的调节机制,为能量过剩引起的代谢紊乱,特别是高糖引起的骨骼肌代谢失调提供了新的理论。
该研究发现,高糖对于AMPK的催化亚基AMPKα的蛋白水平和激酶活性具有双重的抑制作用。首先,高糖刺激促进了细胞中活性氧(ROS)的生成。升高的ROS激活了AKT,使其磷酸化AMPKa的485/491号位的丝氨酸(在AMPKα1中是S485, 在AMPKα2中是S491)位点,而S485/491位点的磷酸化促进了AMPKα招募骨骼肌中高表达的E3泛素化连接酶MG53。先前的研究表明,MG53在代谢综合征的病人和动物模型中表达水平增高,并参与胰岛素信号通路的负调控过程。在这项研究中,肖瑞平课题组发现与AMPKα结合的MG53催化了AMPKα的470赖氨酸位点的泛素化,并导致AMPKα的泛素化依赖性降解,使得AMPKα蛋白水平降低。另外,ROS还引起AMPKα与其上游激酶LKB1的解离。LKB1通过磷酸化AMPKα的172苏氨酸位点激活AMPK,减少与LKB1的相互作用使得T172的磷酸化水平下降,AMPKα的活性因此受到抑制。
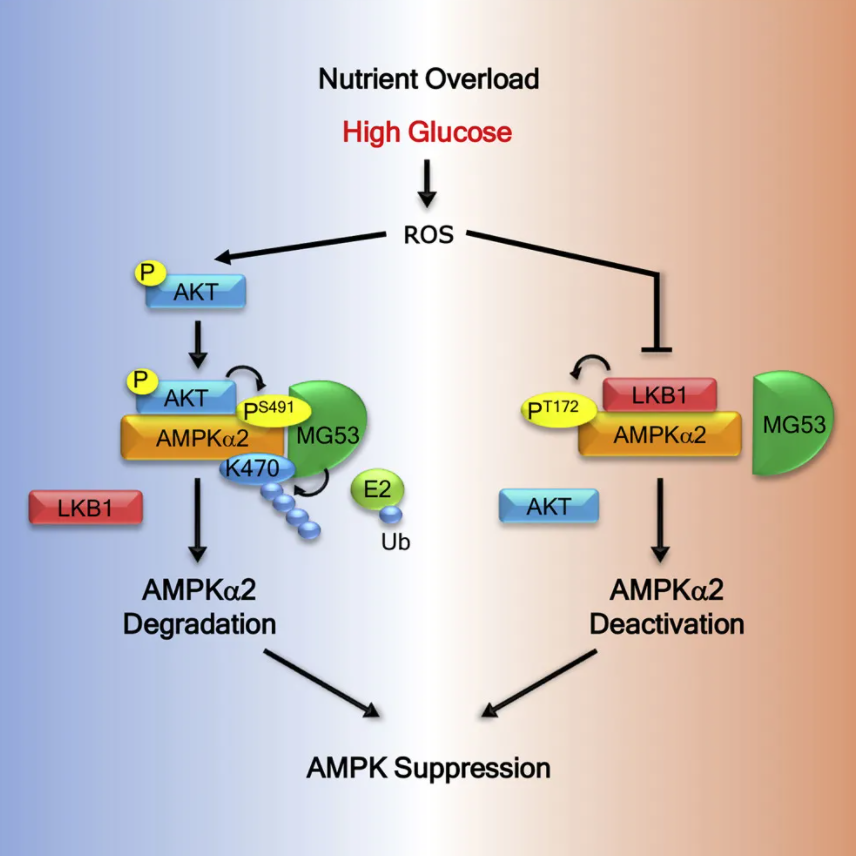
图1.高糖对于AMPK的负调控机制
北京大学未来技术学院分子医学所博士研究生姜鹏、前沿交叉学科研究院生命科学联合中心博士研究生任乐姣和支丽是该论文的共同第一作者,肖瑞平教授及胡新立副研究员为论文的共同通讯作者。该工作得到了科技部重点研发计划、国家自然科学基金、北京市科委和北京市自然科学基金委的支持。https://doi.org/10.1016/j.molcel.2020.12.008


