施一公团队揭开阿尔兹海默重要蛋白γ分泌酶与药物结合全过程
日期:2020-12-29 浏览次数:10979
来源:Bio生物世界
阿尔茨海默症(Alzheimer's disease, AD),俗称“老年痴呆症”,是当今世界范围内患病最广泛、病情最严重的神经退行性疾病,患者通常会出现以记忆力衰退、学习能力减弱为主的症状,并伴有情绪调节障碍以及运动能力丧失,极大地影响个人、家庭乃至社会的发展。目前,全球约有5000万人罹患阿尔兹海默症。随着社会进步,人类平均寿命增长,阿尔兹海默症的患病率也在不断上升,预计到2050年,阿尔兹海默症患者将增加至1.52 亿。令人遗憾的是,科学界至今仍未破译阿尔兹海默症发病的具体机制,更不用说开发相应的治疗方法和药物。γ分泌酶是个蛋白酶,它的功能是去切割或水解其它蛋白质,淀粉样蛋白就是它的水解对象之一,这类蛋白的斑块沉积与阿尔兹海默症的发病关系非常密切。许多针对阿尔兹海默症的药物研发也直接以γ-分泌酶作为靶点。然而,以γ-分泌酶为靶点的药物在临床试验中惨遭失败。2020年12月28日,西湖大学校长施一公院士团队在 Cell 杂志发表了题为:Structural basis of γ-secretase inhibition and modulation by small molecule drugs 的最新研究论文。研究首次报道了γ-分泌酶(γ-secretase)结合三种小分子抑制剂(Gamma-Secretase Inhibitor, GSI)和一种调节剂(Gamma-Secretase Modulator, GSM)的4个原子分辨率冷冻电镜结构,阐明了γ-分泌酶识别不同种类抑制剂及调节剂的分子机理。该研究首次完整展现了γ-分泌酶结合底物与药物的全过程,为了解γ-分泌酶活性调节机制提供了前所未有的精准蓝图,也将极大地推进下一代γ-分泌酶抑制剂及调节剂的设计与优化。
研究人员首先解析了γ-分泌酶与其抑制剂Semagacestat的3.0 Å分辨率结构,发现Semagacestat形成的“位阻”是其发挥抑制作用、产生副作用的机制。接下来,研究人员解析了γ-分泌酶结合另一种抑制剂Avagacestat的3.1 Å的结构。Avagacestat由百时美施贵宝(BMS)研发,目前已进入临床II期试验阶段。结果出乎意料,Avagacestat结合在与Semagacestat几乎一致的位置,也存在‘位阻’,但其相互作用呈现更为‘松散’的状态。这提示我们Avagacestat的底物选择性或许和这些相互作用形式的不同有关。同时,为更全面的阐述所有类型抑制剂的作用机理,研究人员还进一步解析了γ-分泌酶结合过渡状态类似物(TSA)抑制剂L685,458的结构。该研究揭示了三种不同的γ-分泌酶抑制剂的作用机理,分析了其共同点,更重要的是揭示了三者之间的区别,为未来优化和设计具有底物特异性的抑制剂奠定了坚实基础。
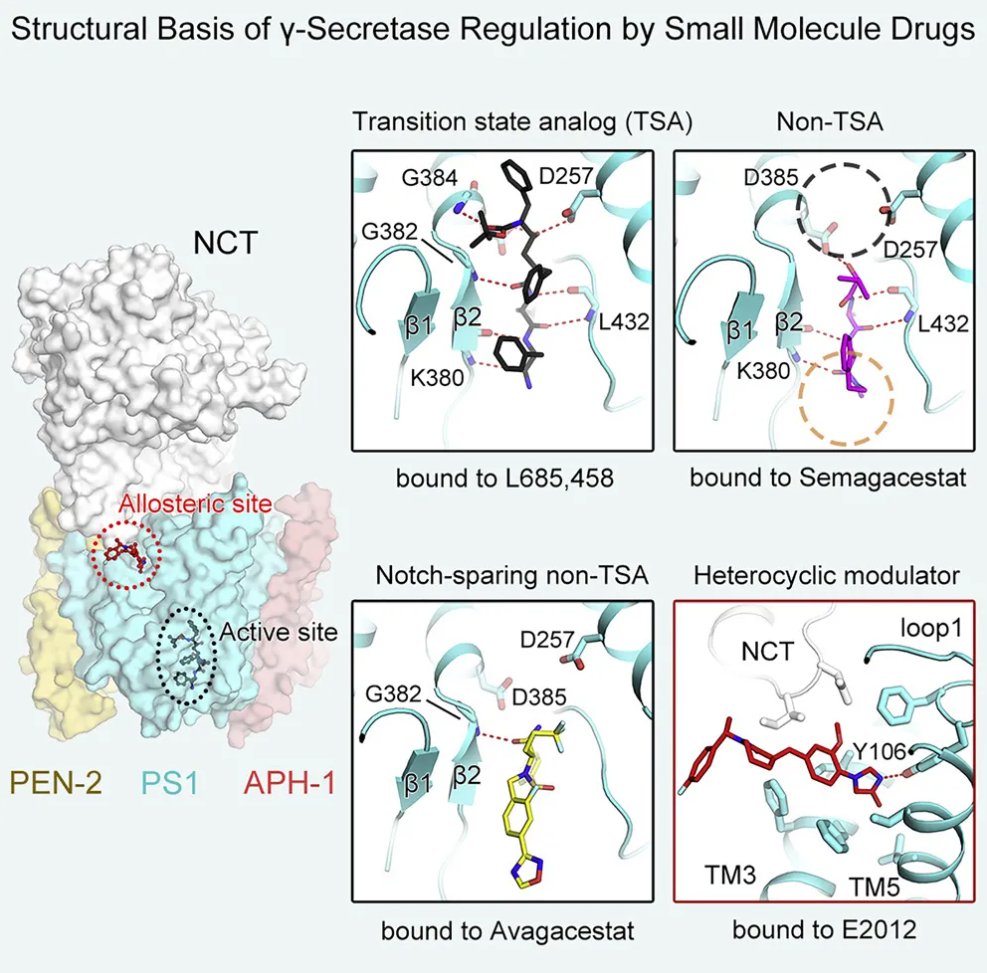
这项研究更清楚的揭示了这些调节剂和抑制剂是怎样抑制底物进入的,为之前临床药物的失败提供了解释,也将极大地推进下一代γ-分泌酶抑制剂及调节剂的设计与优化。
据悉,施一公院士为该研究论文的通讯作者,杨光辉(中国农业大学教授)、周瑞(清华大学生命学院助理教授)、郭雪飞(清华大学生命学院博士生)为论文的共同第一作者。https://www.cell.com/cell/fulltext/S0092-8674(20)31621-4


