

李祥/李海涛组合作开发首个高选择性AF9 YEATS结构域环肽抑制剂
日期:2020-12-23 浏览次数:12545
来源:BioArt
近日,香港大学化学系李祥课题组和清华大学医学院李海涛团队合作于J. Am. Chem. Soc.上发表了文章Selective Targeting of AF9 YEATS Domain by Cyclopeptide Inhibitors with Preorganized Conformation,开发AF9 YEATS结构域首个高选择性环肽抑制剂。该环肽抑制剂表现出38倍选择性,在细胞层面上能特异性靶向AF9 YEATS结构域并能降低相关致癌基因的表达。
此前,作者于2018年在Nature Chemical Biology上首次报道了一类靶向AF9和ENL YEATS结构域的高效、特异性抑制剂XL-13a,但是由于AF9和ENL的YEATS结构域非常相似,抑制剂只表现出3-5倍的选择性。基于此,作者通过结构分析, 利用共价键取代分子内氢键,设计并合成出了一系列环肽抑制剂,其中活性最好的JYX-3表现出了0.41 μM的活性,其选择性则更是高达38倍之多。
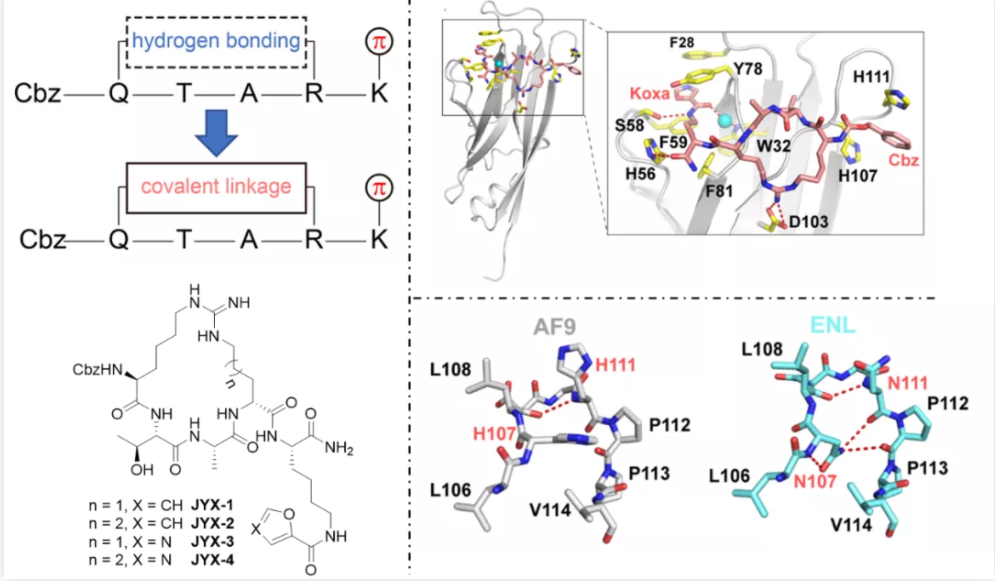
图1. 环肽抑制剂的设计策略以及相应蛋白结构
通过结构比较,作者发现在Loop 8区域上AF9和ENL表现出了一定的不同特性。与AF9相比,Loop 8在ENL中会形成更多的分子内氢键,导致整个结构具有更大的刚性,从而不易接受外来的配体分子。此外Cbz基团会与AF9 Loop 8中的两个组氨酸形成π堆积结构从而增强相互作用,而相对应的位置在ENL中则是两个天冬酰胺并没有发现π堆积结构的存在。这些结构上的发现预示着Loop 8区域将会是实现抑制剂高选择性的关键点。
为了验证这一假设,作者首先做了相应的SAR研究,通过采用不同的基团取代原有Cbz基团,设计合成出了一系列环肽抑制剂类似物,最终发现Cbz基团仍然是最佳结构。为了进一步阐述Cbz对抑制剂选择性的贡献,作者又相继对AF9和ENL YEATS结构域进行了突变,获得了相对应的双突变体AF9NN和ENLHH。活性结果表明,其选择性竟然相应地实现了反转,由原先的38倍选择性变成了0.25倍。无论是SAR还是蛋白突变体的研究都进一步阐述了Cbz基团与组氨酸形成的π堆积结构对环肽抑制剂选择性的决定作用。
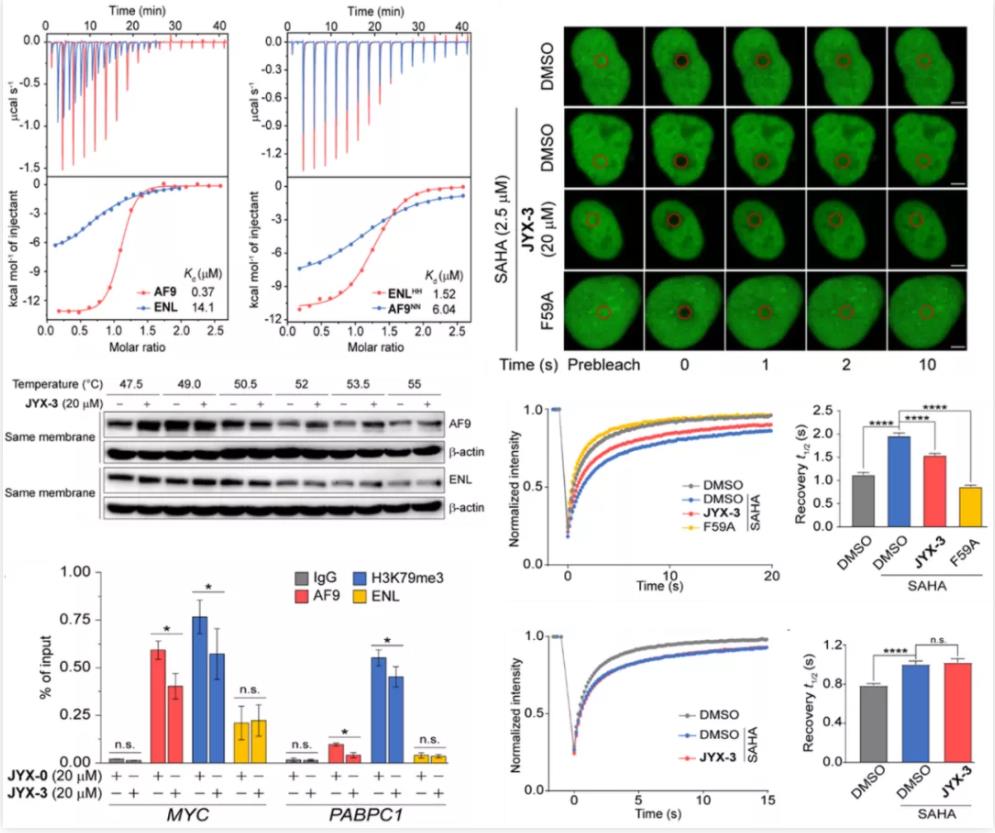
图2. JYX-3对AF9的高选择性以及细胞层面的作用
接下来,作者对JYX-3开展了细胞层面的活性研究。在活细胞内热稳定性迁移实验(Cellular Thermal Shift Assay,CETSA)中, JYX-3显示出良好的细胞通透性,并能特异性地靶向细胞内源的AF9而不会作用于内源的ENL蛋白。此外,作者又利用荧光漂白恢复技术(Fluorescence Recovery after Photobleaching,FRAP)证明了JYX-3能有有效阻止AF9与染色质的结合,而相应地对ENL却没有明显作用,进一步验证了其在细胞层面上的选择性。更重要的是,ChIP-qPCR和RT-PCR实验表明在HeLa细胞系中,JYX-3处理会阻碍AF9和其靶基因(MYC和PABPC1)的结合并显著性降低这些致癌基因的表达。
此项研究近期发表于J. Am. Chem. Soc.,李祥组博士研究生姜益翔、李海涛组研究助理陈国超以及李祥组李晓萌博士为共同第一作者,李祥教授和李海涛教授以及各自课题组的李歆博士和李元元博士为共同通讯作者。
香港大学化学系李祥实验室长期致力于开发新颖化学方法以探究表观遗传学领域的相关问题,重点关注在解析组蛋白修饰的调节机制和它们的生物学意义。课题组擅长开发化学工具,并综合运用蛋白质组学、生物化学、细胞生物学、生物物理学等多种手段开展研究。近年的工作重点主要包括:1)开发光亲和性探针(photoaffinity probe)寻找新型组蛋白修饰的调控酶和效应蛋白;2)表征新型组蛋白修饰对核小体及染色体动态结构的影响;3)靶向组蛋白修饰相关蛋白化学探针的开发。