

袁钧瑛团队报道可同时抑制细胞死亡并激活自噬的小分子化合物——激活自噬恢复细胞内稳态并清除病理蛋白聚集物
日期:2020-09-24 浏览次数:15057
来源:BioArt
神经退行性疾病是影响人类身体健康的重大疾病,但我们目前还没有有效的干预措施,神经退行性疾病(ND),比如阿尔兹海默症(AD)和渐冻症(ALS),有几个重要的病理特征:一是小胶质细胞介导的神经炎症;二是神经系统内的细胞死亡;三是细胞内稳态的失调造成的病理蛋白的聚集,比如AD中的Aβ淀粉样蛋白,Tau蛋白缠结等等。目前主流观点认为上述三个因素是造成ND发生和发展的重要原因。
目前针对ND的干预研究主要包括抑制神经炎症和细胞死亡,哈佛医学院袁钧瑛团队过去20年的工作建立了RIPK1在细胞死亡和炎症反应中的关键作用,并开发了RIPK1的抑制剂。比如之前发现在衰老引起的伴TBK1突变导致的渐冻症(ALS)中,蛋白激酶RIPK1介导的小胶质细胞炎症和少突胶质细胞死亡是造成疾病发生的重要原因。另外,在伴OPTN突变的ALS和AD中,RIPK1介导的神经炎症和细胞死亡都参与了疾病的进程(Ito, et al., 2016, Science; Ofengeim, et al., 2017, PNAS.)。所以,抑制RIPK1的激酶活性是一种重要的干预ND的策略,RIPK1抑制剂也已经在进行多种ND的临床试验,包括AD和ALS。
但是,抑制RIPK1并不能解决ND的第三个问题:细胞稳态的失调而造成的病理蛋白的聚集。如果仅仅抑制神经炎症和细胞死亡,有些疾病中的细胞很可能没有办法恢复内稳态,这会影响它们正常功能的发挥。而我们知道激活细胞内的自噬途径(autophagy),可以促进病理蛋白聚集物的降解。但是激活自噬并不能抑制神经炎症和细胞死亡。因此亟需一种全新的策略可以同时抑制细胞死亡和炎症并激活自噬。
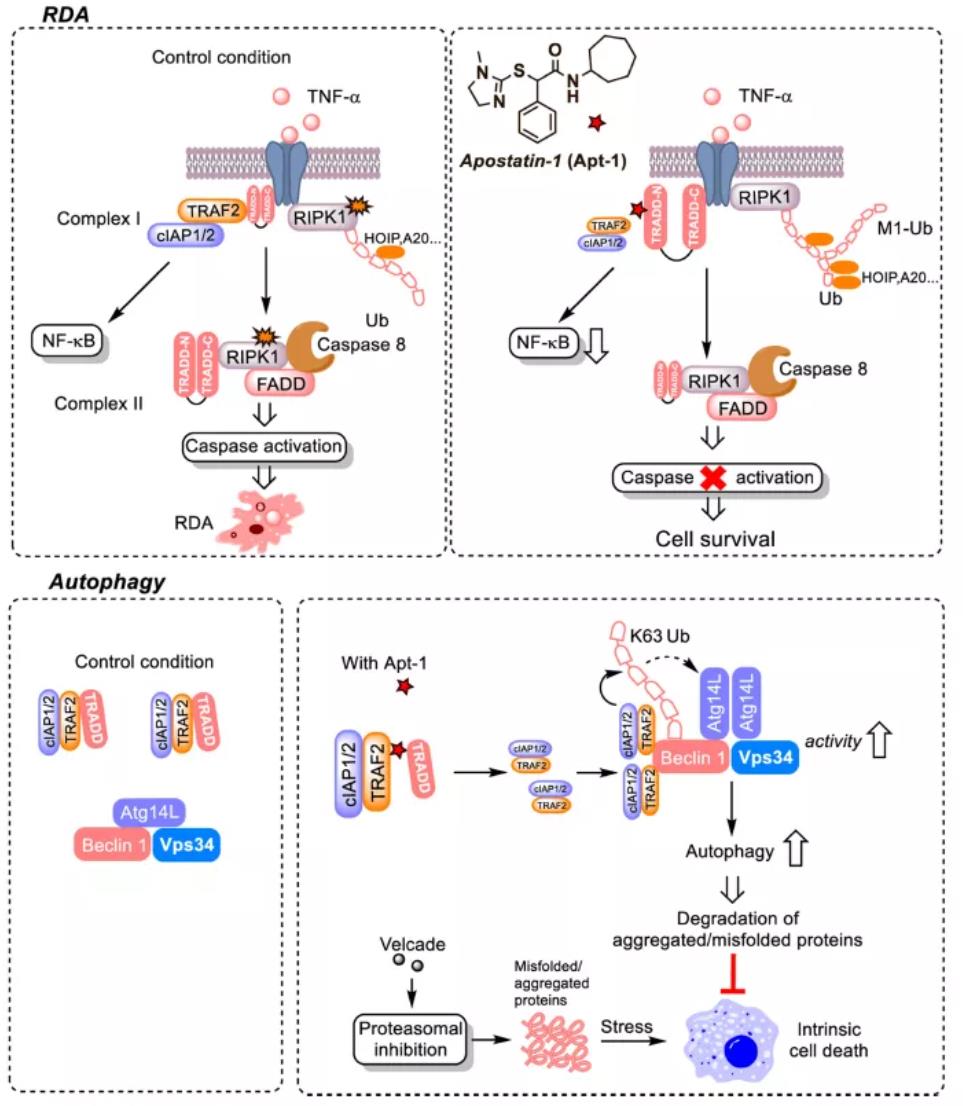
2020年9月23日,袁钧瑛团队(共同一作为许代超和Heng Zhao博士)在Nature上发表文章Modulating TRADD to restore cellular homeostasis and inhibit apoptosis。研究人员参考了之前RIPK1及其抑制剂Nec-1的发现过程 (Degterev et al. 2005),采用化学遗传学,运用复合的小分子化合物高通量筛选模式,寻找能够同时抑制细胞死亡并激活自噬的小分子化合物Apostatin-1,并进一步确认了小分子的作用靶点—TRADD。
研究人员分别采用了RIPK1依赖的细胞死亡模型和细胞自噬模型,从17万个化合物中进行了多轮的筛选,最后找到了符合上述要求的小分子(ICCB-17和ICCB-19)。进一步通过构效改造(SAR),获得了活性较高的小分子,并命名为Apostatin-1。通过大量的细胞生物学实验和生化实验证明了Apostatin-1的靶点是一个叫做TRADD的衔接蛋白。通过体外和体内证明了靶向TRADD可以达到上述两个目标,即抑制RIPK1的活化,和激活自噬恢复细胞内稳态并清除病理蛋白聚集物。
TRADD基因敲除的小鼠被证明不仅是完全健康的,而且对肿瘤坏死因子TNFα以及脂多糖LPS诱导的系统性炎症综合征(SIRS)和死亡都有抵抗作用,因此靶向TRADD将是非常安全的。这项用时8年的工作为治疗人类神经退行性疾病提供了新的方向。
原文链接
https://doi.org/10.1038/s41586-020-2757-z