

文波组发现组蛋白去甲基化酶KDM7A相分离形成新型核体
日期:2020-09-21 浏览次数:16028
来源:BioArt
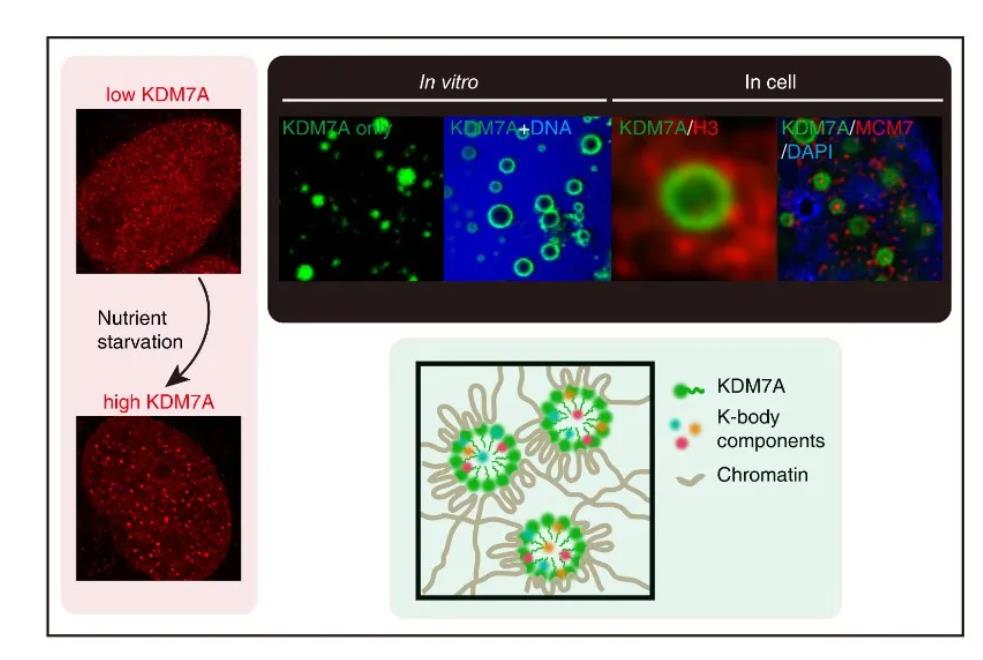
2020年9月16日,复旦大学代谢分子医学教育部重点实验室/基础医学院文波课题组在Protein & Cell上在线发表题为“The Nuclear bodies formed by histone demethylase KDM7A” 的研究论文。该研究发现细胞在饥饿状态下通过上调组蛋白去甲基化酶KDM7A的蛋白水平形成一类以染色质为骨架的新型核体。
该研究进一步通过高分辨率显微镜和电子显微镜观察到过表达外源KDM7A形成的K-Body呈空心结构,并且核体周围有染色质富集。随后,研究者通过FRAP,活细胞成像以及体外液滴形成等实验证明了K-Body通过KDM7A介导的液-液相分离而形成。而在KDM7A蛋白体外形成的液滴中加入DNA可以导致KDM7A空心蛋白凝聚体的形成,与细胞核内图像相符合。由此作者证明了染色质在核体形成过程中可以充当骨架的作用。
原文链接:
参考文献:
1. Jain, S., et al., ATPase-Modulated Stress Granules Contain a Diverse Proteome and Substructure. Cell, 2016. 164(3): p. 487-98.
2. Spector, D.L., SnapShot: Cellular bodies. Cell, 2006. 127(5): p. 1071.
3. Li, Y., et al., B1 oligomerization regulates PML nuclear body biogenesis and leukemogenesis. Nat Commun, 2019. 10(1): p. 3789.
4. Stanek, D. and A.H. Fox, Nuclear bodies: news insights into structure and function. Curr Opin Cell Biol, 2017. 46: p. 94-101.