杨茂君组报道完整的人源线粒体钙单向转运体MCU结构
日期:2020-09-04 浏览次数:13044
本文来源:BioArt
线粒体Ca2+在调节ATP的产生、细胞分裂以及细胞死亡方面发挥着重要作用,线粒体的Ca2+摄取由位于线粒体内膜上的线粒体钙单向转运体(mitochondrial Ca2+uniporter, MCU)完成。2011年该复合物被鉴定以来,围绕该复合物的研究异常火热。完整的高等真核生物的线粒体钙单向转运体主要由四个亚基组成,包括核心亚基MCU、EMRE以及辅助亚基MICU1、MICU2,低钙下,MICU1/MICU2抑制Ca2+通过MCU进入线粒体,高钙下MICU1/MICU2促进MCU的Ca2+转运。结构生物学家争先求索,由组成比较简单的真菌复合物入手,逐渐深入到复杂的人源复合物,从结构生物学的角度揭示了MCU领域的许多重大问题,尤其解释了低Ca2+下MICU1/MICU2如何抑制Ca2+通过MCU进入线粒体,相关文章发表在Nature、Cell、Science和Elife等杂志上【1-6】。然而悬而未决的问题是:高Ca2+下MICU1/MICU2如何实现对MCU的激活?EMRE为什么是高等真核生物必需的?
2020年8月30日,清华大学杨茂君课题组在Protein & Cell在线发表了题为 Structure of intact human MCU supercomplex with the auxiliary MICU subunits 的研究论文(该工作于2020年4月4日率先在BioRxiv上线)。研究团队使用哺乳动物细胞系统表达纯化了包含辅助亚基MICU1/MICU2的人源线粒体钙单向转运体的复合物,并通过冷冻电镜解析了完整的MCU-EMRE-MICU1-MICU2的复合物结构。MCU:EMRE:MICU1:MICU2的比例为8:8:2:2,跨膜区结合了丰富的磷脂。位于膜间隙的一对MICU1/MICU2异源二聚体像“帽子”一样,位于V型MCU-EMRE八聚体的边缘,形成整体呈现O型的结构。MICU1/MICU2 C端螺旋锚定在线粒体内膜上,进而在不同Ca2+浓度条件下将MICU1/MICU2始终固定在MCU/EMRE的周围。MICU1/MICU2通过EMRE与MCU关联起来,每一个MICU1分别与两个EMRE相互作用,相互作用位点位于MICU1的N端poly K、S339K340K341结构域和EMRE的C末端。
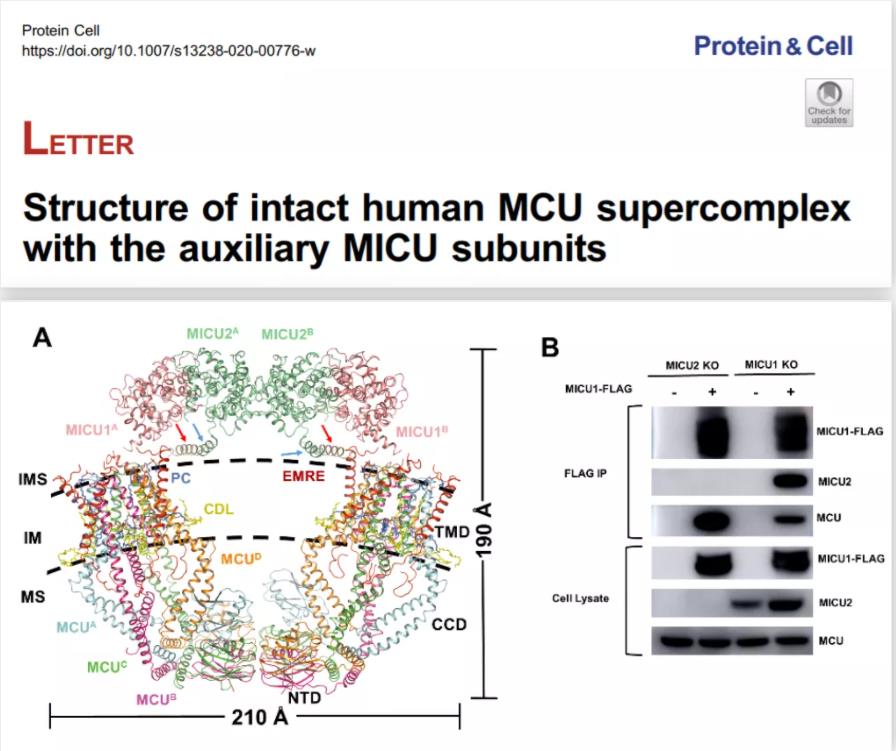
图1 完整的MCU-EMRE-MICU1-MICU2结构和验证
研究组发现,在EMRE KO细胞中,回补EMRE C末端截短突变体后,细胞的Ca2+转运能力显著下降;而在MICU1/MICU2/EMRE 3KO细胞中,回补EMRE C末端截短体的细胞和回补完整EMRE的细胞具有相同的Ca2+转运能力,揭示了高Ca2+下MICU1/MICU2通过与EMRE C末端相互作用进而促进Ca2+离子转运。结构显示,MCU的R297和EMRE的V61主链上的碳,以及磷脂的头部形成氢键,Ca2+转运实验揭示了打破这些相互作用的MCU R297D突变体完全丧失了Ca2+转运能力。综合结构分析和转运实验,研究组提出了高等真核生物的EMRE通过杠杆机制介导MICU1/MICU2调节Ca2+转运的作用机理。
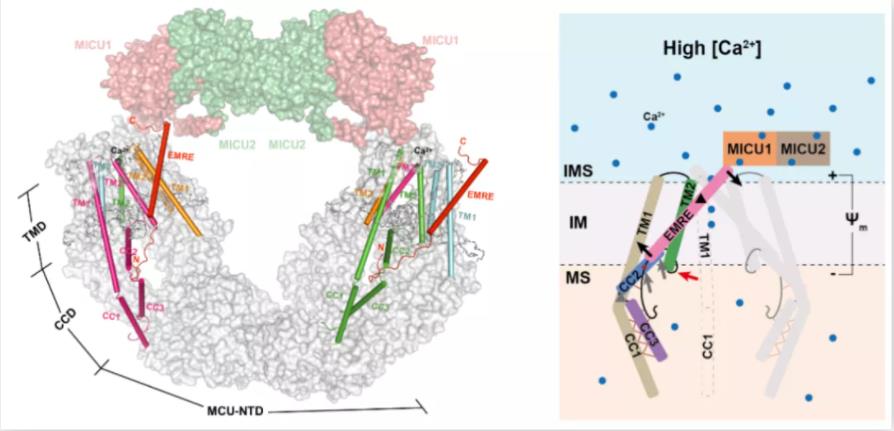
图2 EMRE通过杠杆机制介导MICU1/MICU2调节Ca2+转运模型
总的来说,该工作报道了目前为止分辨率最高的MCU-EMRE-MICU1-MICU2的结构,结构分析结合功能验证回答了高Ca2+下MICU1/MICU2如何实现对MCU的激活和 EMRE为什么是高等真核生物必需的这两个重要问题。
据悉,清华大学生命学院杨茂君教授、课题组博士后卓微和南方科技大学王培毅教授为本文共同通讯作者,清华大学生命学院博士后卓微、周珩、郭润域、张来幸和博士生易静波为本文共同第一作者。
http://link.springer.com/article/10.1007/s13238-020-00776-w
参考文献:
-
Fan, M., Zhang, J., Tsai, C.-W., Orlando, B. J., Rodriguez, M., Xu, Y., Liao, M., Tsai, M.-F., Feng, L. Structure and mechanism of the mitochondrial Ca2+ uniporter holocomplex. Nature. 2020 Jun;582(7810):129-133.
-
Wang, Y., Nguyen, N. X., She, J., Zeng, W., Yang, Y., Bai, X.-C., Jiang, Y. Structural mechanism of EMRE-dependent gating of the human mitochondrial calcium uniporter. Cell. 2019 May 16;177(5):1252-1261.
-
Fan, C., Fan, M., Orlando, B. J., Fastman, N. M., Zhang, J., Xu, Y., Chambers, M. G., Xu, X., Perry, K., Liao, M., Feng, L. X-ray and cryo-EM structures of the mitochondrial calcium uniporter. Nature. 2018 Jul;559(7715):575-579.
-
Baradaran, R., Wang, C., Siliciano, A. F. & Long, S. B. Cryo-EM structures of fungal and metazoan mitochondrial calcium uniporters. Nature. 2018 Jul;559(7715):580-584.
-
Nguyen, N. X., Armache, J. P., Lee, C., Yang, Y., Zeng, W., Mootha, V. K., Cheng, Y., Bai, X.-C., Jiang, Y. Cryo-EM structure of a fungal mitochondrial calcium uniporter. Nature. 2018 Jul;559(7715):570-574.
-
Yoo, J., Wu, M., Yin, Y., Herzik, M. A. Jr, Lander, G. C., Lee, S.-Y. Cryo-EM structure of a mitochondrial calcium uniporter. Science. 2018 Aug 3;361(6401):506-511.



