

Cell:颜宁/尹航提出“饿死疟原虫”新思路
日期:2020-08-31 浏览次数:11427
来源:Bio生物世界
2020年8月28日,颜宁团队与尹航团队合作在 Cell 上在线发表题为:Structural Basis for Blocking Sugar Uptake into the Malaria Parasite Plasmodium falciparum(抑制恶性疟原虫糖摄入的结构基础)的重要研究成果。
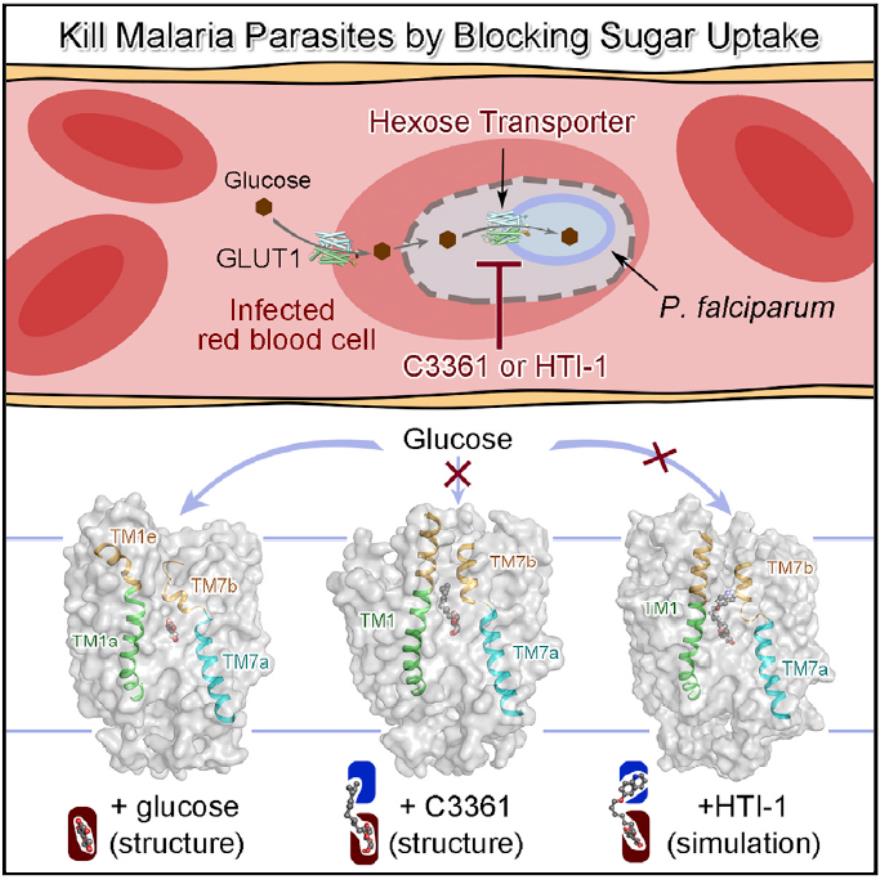
该论文报道了PfHT1分别结合天然底物葡萄糖和一个已知的选择性与抑制效果都比较微弱的抑制剂C3361的两个结构。出乎意料,C3361的结合导致了PfHT1巨大的构象变化,衍生出一个全新的空腔结构,可以用来作为靶点进行抑制剂的设计与优化。在此发现的基础上,团队成员开发出了一系列具有更高亲和力的选择性抑制剂,在原虫抑制实验中确认可以有效杀死疟原虫,却对人源细胞无害,从而为开发新一代抗疟药物开辟了道路。
在发表 Cell 论文的同时,两个团队还合作在生物领域预印本平台 bioRxiv 上发表了题为:Orthosteric-allosteric dual inhibitors of PfHT1 as selective anti-malarial agents(靶向PfHT1蛋白正构-别构双位点的选择性抗疟药物开发)的研究成果。
在这一文章中进一步详细阐明了新一代小分子抑制剂系列的设计思路和构效关系,并通过一系列的原虫抑制实验验证了该系列小分子抑制剂的高杀伤性、低细胞毒性以及针对原虫多个繁殖周期都具有良好抑制效果的多周期性,从而为该系列抗疟药物的进一步开发奠定了基础。
综上,研究团队针对疟疾耐药性不断增加的现状,通过对底物或抑制剂结合状态下的PfHT1蛋白结构解析,鉴定了新的药物结合位点并设计出一系列高效的“正构-别构”双位点抑制剂。通过抑制疟原虫对葡萄糖的摄取 “饿死疟原虫”,这代表着一种新型抗疟药物研发思路,为下一代抗疟药物的研发奠定了基础。
值得一提的是,饶子和院士评价上述工作时称:“研究团队以阻断疟原虫能源摄取为新手段开发的新一代化合物有望解决日趋严重的疟疾耐药性问题;同时靶向膜转运蛋白的正构及别构调节位点的抑制剂设计思路非常具有创造性,也为其他药物理性设计提供了参考”。
据悉,文章的共同通讯作者为原清华大学生命科学学院、医学院、现普林斯顿大学分子生物学系教授颜宁和清华大学药学院教授尹航,共同第一作者为现已毕业的清华大学生命科学学院博士蒋鑫、清华大学生命科学学院博士后袁亚飞、清华大学化学系2016级博士生黄健与清华大学生命科学学院2017级博士生张硕。
论文链接:
https://doi.org/10.1016/j.cell.2020.08.015
https://www.biorxiv.org/content/10.1101/2020.08.25.260232v1