

朱金伟/张荣光/张明杰合作揭示酶复合物自发相分离形成模块化无膜细胞器调控多种细胞功能
日期:2020-08-12 浏览次数:16109
来源:BioArt
信号蛋白复合物(包括酶)在特定的亚细胞区域聚集是细胞信号转导的关键过程。在这一过程中,信号蛋白通过传统热力学原理介导的蛋白-蛋白相互作用被招募到特定的细胞区室高效调节信号转导。近年来研究发现,生物大分子能够通过液-液相分离(liquid-liquid phase separation, LLPS)机制聚集相关信号蛋白,形成无膜区室(membraneless compartment),LLPS提供了一种高效富集信号蛋白如酶复合物的全新方式,使生化反应在特定细胞区室独立、高效、有序的进行【1-3】。
一般认为,LLPS的发生主要由以下两种机制介导:1.蛋白固有无序区域(intrinsic disorder region)或低复杂度区域(low complexity region)间的多价弱相互作用;2. 支架蛋白(scaffold protein)间通过多价的特异相互作用网络,形成相分离【4】。由于它们量少、活性高、反应特异,酶或酶复合物一般被认为是作为“乘客”进入无膜细胞器。
2020年8月10日,上海交通大学Bio-X研究院朱金伟团队、中科院上海生物化学与细胞生物学研究所张荣光团队和香港科技大学张明杰团队合作在Molecular Cell杂志发表了题为GIT/PIX Condensates Are Modular and Ideal for Distinct Compartmentalized Cell Signaling的研究论文。该研究发现GIT/PIX这对酶复合物通过多价特异相互作用,自发的形成相分离;GIT/PIX复合物无膜细胞器作为一个通用模块(module)通过与不同接头蛋白(adaptor)的相互作用被定位到细胞的不同区域发挥功能。
GIT是Arf GTPase的GTP酶活化蛋白(GAP),其ArfGAP结构域能够使Arf GTPase失活;PIX是Rho GTPase的鸟苷酸交换因子(GEF),其经典的DH-PH催化结构域能够激活Rho GTPase。有趣的是,GIT、PIX在体内常常以复合物形式存在。这对GAP/GEF复合物在很多细胞过程发挥功能,比如神经突触信号转导,细胞迁移,免疫反应等,其功能缺失也与一系列疾病的发生紧密相关【5】。但是,这对酶复合物的组装机制仍不明确。作者首先利用生化方法研究了GIT/PIX间的相互作用,发现GIT的GAP-ANK-SHD串联结构域(GAS)能够特异识别PIX的一段多肽片段(GIT-binding domain,GBD),其结合解离常数KD约为15nM。随后,作者解析了GIT/PIX复合物的三维结构(图1)。
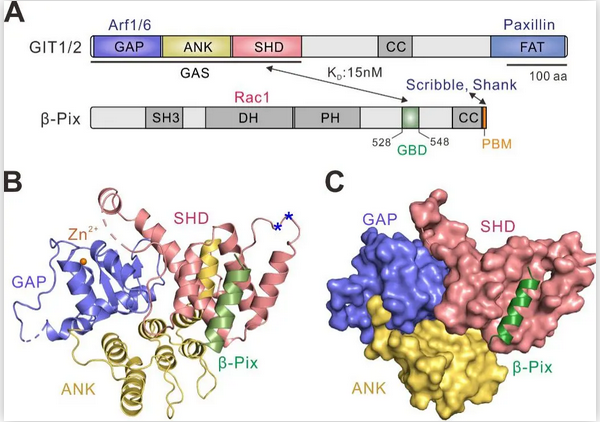
图1. GIT/PIX相互作用及其复合物结构


图3. GIT/PIX模块化无膜细胞器调控多种细胞信号转导通路
参考文献:
1. Banani, S.F., Lee, H.O., Hyman, A.A., and Rosen, M.K. (2017). Biomolecular condensates: organizers of cellular biochemistry. Nat Rev Mol Cell Biol. 18, 285–298.