刘聪/李艳梅合作揭示翻译后修饰调控帕金森病致病蛋白α-syn的液-固相转化与聚集的分子机制
日期:2020-08-06 浏览次数:13867
来源:BioArt
蛋白质的翻译后修饰(PTM)在动态调控蛋白构象和功能中起到至关重要的作用。生物信息学分析显示PTM高度富集与蛋白质的固有无序区域intrinsic disordered region (IDR)。近年来,大量研究表明蛋白质的IDR是驱动蛋白质相分离与相转化的关键区域。因此,PTM对于蛋白质相分离的调控具有重要的作用。然而,目前相关的研究(特别是从分子原子层面阐释PTM如何调控蛋白相分离)还相对比较匮乏。近日,上海有机化学研究所生物与化学交叉中心刘聪与清华大学李艳梅课题组合作,发现在帕金森病患者富集的α-syn 39位Tyr磷酸化修饰 (pY39) 对于α-syn的液-固相转化以及致病淀粉样聚集具有重要的调控作用,并进一步阐释pY39磷酸化介导α-syn形成病理性聚集体的分子机制和结构基础。相关的工作发表于PNAS上,题为:Parkinson’s disease-related phosphorylation at Tyr39 rearranges α-synuclein amyloid fibril structure revealed by cryo-EM。在本工作中,研究者首先通过化学半合成的方法在体外获得具有高纯度和均一性的39位Tyr磷酸化α-syn蛋白样品 (pY39 α-syn)。对比于未修饰的α-syn,pY39 单个位点的翻译后修饰完全改变了α-syn液-固相转变的动力学特征以及淀粉样聚体的形式。更为重要的是,细胞实验表明pY39 α-syn形成的致病淀粉样聚集体,对于神经元具有更强的细胞毒性,并能诱导神经元中更多的内源α-syn经历液-固相转化进而形成病理性蛋白聚集体。进一步通过低温冷冻电镜技术,研究人员解析了pY39 α-syn形成的具有两种不同堆叠模式的淀粉样聚集体的高分辨结构(包括:twist-dimer fibril和twist-trimer fibril)(图1)。有趣的是,pY39 α-syn形成了与未修饰的野生型α-syn完全不同的纤维结构。pY39的磷酸基团吸引α-syn 氨基端的多个Lys,形成一个包含有hydrophilic channel的淀粉样纤维的核心结构单元(fibril core)(图1)。Fibril core进一步通过疏水相互作用把α-syn前100个氨基酸残基全部组装形成目前已知的最大的α-syn原纤维结构(图1)。结构上的稳定性使pY39 α-syn的淀粉样纤维显示出更强大的耐受不同蛋白水解酶降解的能力。
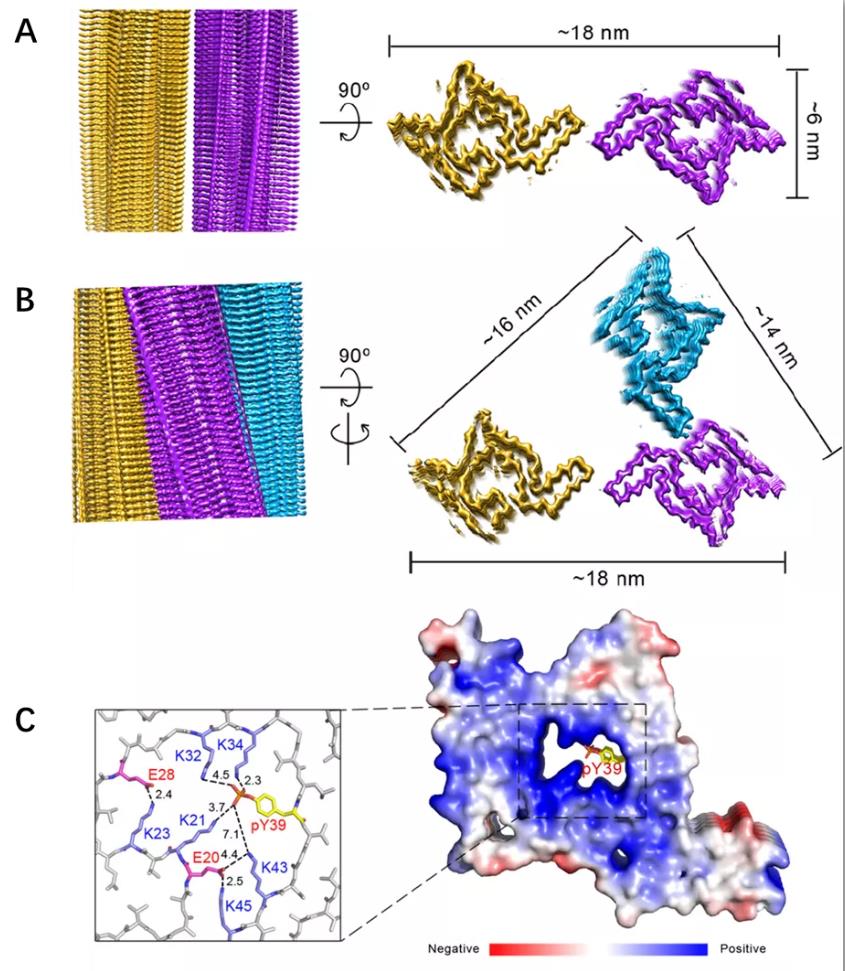
pY39 α-syn淀粉样纤维的电镜结构
综上,本工作系统研究了一类重要的帕金森病致病相关的翻译后修饰pY39在调控α-syn固-液相转化以及其病理毒性的核心作用。首次在原子分子水平揭示单位点磷酸化就能够介导全新的淀粉样蛋白聚集体结构的形成,拓展了翻译后修饰对于蛋白相分离调空研究的维度和深度,为翻译后修饰导致的蛋白相分离紊乱以及其在神经退行性疾病种的病理作用的研究提供了新思路。
另外值得一提的是,刘聪课题组与上海交通大学Bio-X的李丹课题组长期合作进行α-syn液-固相转化的调控及其在帕金森病中的作用的研究。除了本工作报道的PTM调控α-syn聚集的研究之外,近期还与清华大学李雪明以及北京大学的苏晓东课题组,合作系统研究了不同的帕金森病家族性遗传突变(A53T及E46K)对于α-syn液-固相转变以及致病淀粉样聚集组装结构与毒性的影响。相关工作阐释了研究了不同的家族性遗传单点突变直接影响α-syn淀粉样纤维聚集的组装模式以及动力学特征,从而导致更强的细胞毒性。为α-syn家族性点突变引起早发性帕金森病的研究提供了新的思路。相关工作分别与2020年3月,4月发表在Cell Research 以及Nature communications 上。 综上,刘聪课题组的系统研究为阐释病理条件下遗传以及环境因素对于蛋白质相分离以及致病性淀粉样聚集体的调控及其在帕金森病中的致病作用的分子机制提供了坚实的基础。
原文链接
https://www.pnas.org/content/early/2020/07/30/1922741117


