

Andrew Z. Xiao/李海涛合作发现DNA 6mA修饰影响染色质结构
日期:2020-07-16 浏览次数:9609
本文来源:BioArt
作为细菌中丰度最高的DNA修饰,6mA直到2015年才首次被报道存在于真核生物的基因组中【1-3】。随后,许多研究的跟进发现6mA也存在于哺乳动物和高等植物的基因组。然而,这些研究对于6mA的丰度,分布和功能阐述有较大差异,并且由于6mA在基因组中的丰度较低,且其鉴定易受细菌污染的影响,目前关于6mA是否存在于真核生物基因组中,以及是否具有生理功能,还存在较大的争议(详见BioArt报道:学术争鸣 | 从迷雾重重到柳暗花明?全面起底DNA 6mA修饰相关研究的争议)。
2016年,耶鲁大学的Andrew Z. Xiao教授首次在小鼠胚胎干细胞中鉴定了DNA 6mA的存在【4】,然而另两个独立课题组却未能重复出相似的结果【5-6】,因此关于6mA在小鼠胚胎细胞中的鉴定和功能还需进一步研究。同时,何川教授等发现核基因组的6mA含量稀少,而线粒体基因组中的6mA则丰度更高【7】,提示线粒体是研究6mA功能的潜在理想模型,那么核基因组中的6mA是否还能获得研究者的关注呢?
2020年7月15日,Andrew Z. Xiao教授和清华大学的李海涛教授合作在Nature发表研究“N6-methyladenine in DNA antagonizes SATB1 in early development”,阐述了DNA 6mA修饰通过抑制SATB1在SIDD区的结合,从而调控染色质状态并影响胚胎早期发育进程的机制。
由于6mA在小鼠胚胎干细胞(mES)中的丰度较低(百万分之6-7),研究者首先寻找适宜的细胞培养条件来提高6mA的含量。值得注意的是,在四倍体补偿实验(tetraploid complementation,4N)中,6mA丰度与不同培养条件下mES的发育潜力呈正比。也就是说,在传统的2i(加入ERF和GSK3b抑制剂)条件中(4N阴性),6mA水平显著降低;而在其他2i条件下(4N阳性),6mA的水平则得以保留。mES细胞培养条件的差异可能是造成不同课题组关于6mA丰度争议的原因。
以小鼠滋养层干细胞(trophoblast stem cells)为模型,m6A的丰度在TS-like细胞时期显著上升,随后下降(图1 )。

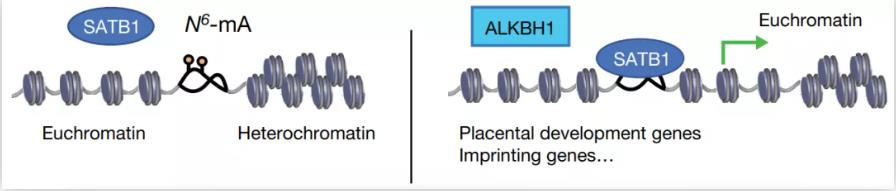
DIP-seq显示6mA主要位于AT含量高的基因间区域(intergenic regions),比如转座子LINE-1s,与之前的研究一致【4】。特别地,进一步分析显示6mA主要位于SSID区(stress-induced DNA double helix destabilization)。SSID区有助于推动拓扑压力诱导的DNA双螺旋不稳定,对染色质结构的组织有重要作用,包括建立和维持异染色质-常染色质边界和DNA的长距离互作等。SATB1是SSID的调节蛋白,可以直接结合并稳定DNA双螺旋结构。
那么,6mA是否会影响调节蛋白,比如SATB1,在SSID区的结合呢?确实,分析显示在in vitro和in vivo条件下,6mA都能显著的阻碍SATB1对DNA的结合。过表达6mA去甲基化酶ALKBH1后(注意,免疫荧光显示过表达的ALKBH1主要定位在细胞核,而非线粒体,可排除ALKBH1对线粒体DNA 6mA的影响),6mA降低的位点的染色质变得更加开放,异染色质区域也被打开,这说明6mA通过拮抗SATB1维持染色质的常染色质-异染色质边界。
为进一步研究6mA在胚胎发育中的功能,研究者构建了ALKBH1缺失的小鼠。虽然ALKBH1缺失的杂合小鼠可以出生,但是纯和小鼠却不能。ALKBH1的缺失抑制了TSC细胞向TGC细胞的分化,这说明6mA在胚胎发育中具有重要作用。同时,SATB1的敲除也有与ALKBH1缺失相似的表型,说明6mA主要通过拮抗SATB1发挥功能。
总的来说,该研究发现6mA通过拮抗SATB1在发育的早期调节染色质结构(图2),为研究表观遗传修饰调控染色质结构和基因表达提供了新的思路,具有重要意义。
https://doi.org/10.1038/s41586-020-2500-9