浙大闵军霞团队揭示胃肠道肿瘤靶向治疗耐药重要机制
日期:2020-07-10 浏览次数:7029
来源:BioWorld
最新世界癌症统计数据显示,胃肠道肿瘤不仅高发(约15.9%的发生率)而且致死率超过17.4%,严重危害人类健康。而ERBB3在胃肠道肿瘤中存在非常高的突变频率(约为12%),远远高于肺癌(2%)、乳腺癌(2%)等其它癌症类型。因此,ERBB3突变基因在胃肠道肿瘤中的作用及机制亟待研究。
7月7日,浙江大学医学院/转化医学研究院闵军霞团队在 Protein & Cell (影响因子10.164)在线发表题为:Rewiring ERBB3 and ERK Signaling Confers Resistance to FGFR1 Inhibition in Gastrointestinal Cancer Harbored an ERBB3-E928G Mutation 的研究论文。该研究通过功能筛选携带ERBB3(Erb-B2 receptor tyrosine kinase 3)不同突变位点的胃肠道肿瘤细胞系对于临床常用系列酪氨酸激酶抑制剂(Tyrosine Kinase Inhibitors,TKIs)的敏感性,发现携带ERBB3-E928G位点突变的胃肠道肿瘤细胞对成纤维生长因子受体FGFR1抑制剂显著耐受;进一步研究发现通过抑制ERBB3(特异性抗体LJM716或shERBB3)能够有效逆转胃肠道肿瘤细胞对FGFR1抑制剂的耐受。该研究成果首次阐明ERBB3的E928G位点突变导致胃肠道肿瘤靶向治疗耐受的分子调控机制,为临床克服靶向耐药提供了新靶点及新策略。
ERBB3基因于1989年被发现,其同家族成员还包括ERBB1(EGFR),ERBB2(HER2)以及ERBB4。自2004年以来,多项研究提示ERBB3异常激活与肿瘤靶向治疗药物的耐受有关,比如EGFR和HER2抑制剂。2014年,ERBB3被功能验证为Oncogene(促癌基因)。然而突变型ERBB3如何导致肿瘤靶向药物耐受的具体调控机制尚不明确。
研究人员首先通过深度挖掘癌症基因图谱(The Cancer Gene Atlas,TCGA)数据库,在797例胃肠道肿瘤样本中分析了ERBB3基因及其它相关酪氨酸激酶受体(Receptor Tyrosine Kinase, RTK)的基因改变(包括错义突变和扩增)频率,结果发现9%的样本发生ERBB3基因改变,而且绝大部分为错义突变(占所有基因改变的73.3%)。

TCGA数据库分析ERBB3及相关RTK基因在胃肠道肿瘤样本中的突变规律
基于以上胃肠道肿瘤患者中ERBB3突变谱的分析结果,研究人员挑选携带不同ERBB3高频热点突变的胃肠道肿瘤细胞系开展了系列TKIs耐受功能筛选,结果发现:携带E928G位点突变ERBB3的肿瘤细胞系对FGFR1-3的抑制剂BGJ398显著耐受,并进一步利用FGFR1特异性抑制剂PD173074[5]及敲减FGFR1基因表达明确了FGFR1的抑制耐受现象。

携带E928G位点突变ERBB3肿瘤细胞系对FGFR1抑制耐受
此外,研究人员发现携带E929G位点突变ERBB3的肿瘤细胞系中的ERBB3磷酸化水平(pERBB3)显著高于其它肿瘤细胞系,提示ERBB3信号被异常激活。那么,FGFR1抑制耐受现象是否依赖于异常激活的ERBB3?
研究人员一方面利用shRNA敲低肿瘤细胞中的E928G突变ERBB3,降低了pERBB3蛋白水平,结果发现能够有效提高FGFR1抑制剂的肿瘤细胞杀伤效果;另一方面,研究人员选用一种ERBB3特异性抗体LJM716与FGFR1抑制剂对肿瘤细胞进行联合给药处理,同样能够大幅降低肿瘤细胞活力、抑制肿瘤细胞克隆形成并且诱导肿瘤细胞发生凋亡。为了明确相关机制,研究人员系统性研究了ERBB3异常活化的下游信号通路,结果发现E929G位点突变ERBB3的肿瘤细胞中的磷酸化ERK(pERK)的蛋白水平显著高于其它肿瘤细胞系,而且联合抑制突变ERBB3和FGFR1能够显著下调pERK水平,提示ERK信号的异常激活参与调控E928G突变ERBB3肿瘤细胞对FGFR1抑制剂耐受。ERBB3蛋白的胞内激酶区不具备激酶活性,是一种“假激酶”,导致其必须与其它RTK形成异源二聚体才能激活胞内下游信号通路蛋白。有研究发现肿瘤细胞中ERBB3经常与同家族成员HER2或与EGFR形成异源二聚体[6],也能够与其它RTK家族成员,如IGF1-R、c-MET等形成异源二聚体。因此,研究人员进一步研究发现E928G突变型ERBB3而非野生型ERBB3与FGFR1的确存在相互作用,提示E928G位点突变的ERBB3通过与FGFR1形成异源二聚体从而激活下游ERK信号通路,促进肿瘤细胞生存和耐药。该研究是否具有临床转化前景?为了回答这一关键科学问题,研究人员利用荷瘤小鼠模型进行联合给药的系列体内动物研究,结果显示联合靶向抑制突变ERBB3和FGFR1能够显著抑制小鼠肿瘤的生长,为该成果的临床转化提供重要依据。

联合靶向抑制突变ERBB3和FGFR1的荷瘤小鼠抑癌效果
该研究成果通过系统性TKIs耐受筛选,发现携带E928G热点突变ERBB3的胃肠道肿瘤细胞对FGFR1抑制剂显著耐受,其潜在机制是E928G突变ERBB3与FGFR1形成异源二聚体,异常激活ERBB3及下游ERK信号通路,促进肿瘤细胞生存及耐药。
该研究成果为联合靶向突变ERBB3与FGFR1临床治疗胃肠道肿瘤提供坚实的实验基础及新策略。
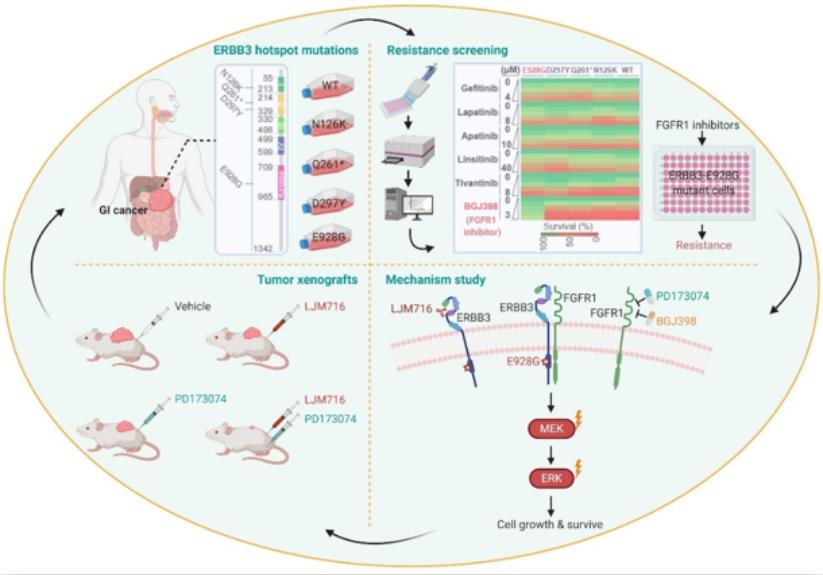
研究成果发现及重要机制模式图
据悉,浙江大学医学院/转化医学研究院闵军霞教授团队博士研究生杨翔和王红晓为共同第一作者;闵军霞教授为通讯作者。该研究工作得到浙江大学医学院王福俤教授团队大力支持。该研究工作获得浙江省自然科学基金、国家重点研发计划和国家自然科学基金经费资助。
链接:http://www.protein-cell.org/en/article/doi/10.1007/s13238-020-00749-z





