

雷鸣团队首次阐释核酶RNase MRP的催化机理
日期:2020-06-30 浏览次数:7059
文章来源:BioArtReports
RNase MRP是存在于所有真核生物中一类保守的由一条非编码RNA催化亚基和近十个蛋白质组成的核糖核酸复合物。它在核糖体rRNA前体成熟过程和细胞周期调控中都扮演着重要的角色。人源RNase MRP RNA组分的突变导致以侏儒、软骨及毛发发育不良等为显著特征的严重发育缺陷型疾病。在组成成分和进化上,RNase MRP都与体内另一类保守且必需的核酶RNase P密切相关。但是二者具有完全不同的底物特异性和底物识别机制,功能上也不具有冗余性。RNase P催化的底物主要是tRNA前体,催化切割pre-tRNA 5’leader进而促进tRNA的成熟。RNase P是通过“double anchor”机制来识别tRNA的acceptor stem结构,不具有序列特异性。
上海交通大学医学院附属第九人民医院精准医学研究院雷鸣团队于2018年,2019年先后解析了酵母、古细菌以及人源RNase P的全酶及其底物复合物结构,详尽阐释了RNase P的底物识别和催化机制,并为这一类地球上所有生物中都存在的核酶提供了进化上新的见解,文章相继发表于Science,Cell和Nature Communications等国际权威学术期刊。
2020年6月25日,雷鸣团队在Science杂志在线发表了题为“Structural insights into precursor ribosomal RNA processing by ribonuclease MRP”的研究论文。该研究揭示了真核生物中一类保守且必需的核酶RNase MRP催化前体rRNA加工成熟的分子机制。
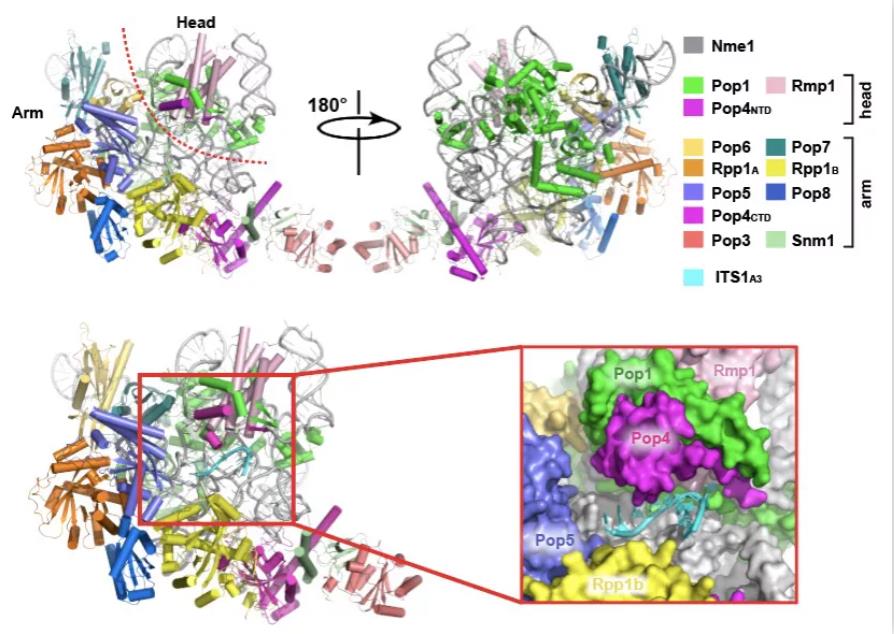
相较于RNase P,RNase MRP催化的底物主要为核糖体rRNA前体,催化切割pre-rRNA 中ITS1区域的A3位点,进而促进核糖体的加工成熟。在该项工作中,雷鸣团队从酵母中成功提取RNase MRP复合物,利用冷冻电镜单颗粒重构技术,分别解析了RNase MRP全酶(2.5Å)和带有底物的复合物(2.9 Å)高分辨率结构,该结构清晰揭示了RNase MRP是如何由RNase P衍化而来并获得了全新的不同的底物特异性。在底物识别方面,RNase MRP摒弃了RNase P所采用的双锚定机制,但在催化核心上,则完全保留了RNase P所采用的双镁离子SN2催化反应机理。
一个核心而关键的问题是:究竟是什么决定了RNase MRP的底物特异性?结合RNase MRP-底物复合物的结构以及体外生化实验表明,位于RNase MRP底物结合口袋周围的几个关键蛋白质亚基相较于RNase P中的结构,其采用了完全不同的折叠方式,赋予了RNase MRP不同的底物特异性。不同于RNase P通过识别底物 tRNA前体的三维结构特征进行催化,它仅识别一段短的单链RNA片段,并且具有一定的序列特异性。
RNase MRP的RNA催化亚基和端粒酶的RNA亚基是目前细胞核内唯一的两个被广泛接受并验证的与人类遗传疾病紧密相关的非编码RNA分子,该项研究工作为理解RNase MRP的催化机理以及突变导致的致病机理提供了坚实的基础。
精准医学研究院兰鹏飞研究员为该论文的第一作者,雷鸣研究员和武健研究员为文章的通讯作者。上海交通大学医学院附属第九人民医院为文章唯一完成单位,所有研究工作均在精准医学研究院完成。
原文链接:
https://science.sciencemag.org/content/early/2020/06/24/science.abc0149