生物物理所杨鹏远课题组揭示了调控肝癌微环境T细胞免疫耐受新机制
日期:2020-06-03 浏览次数:8257
来源:大屯路15号
作者:杨鹏远研究组
肝癌是我国第二大致死癌症,乙肝病毒感染等病毒性肝炎和非酒精性脂肪肝炎等是肝癌的主要诱因。虽然肿瘤免疫检查点治疗在临床上的应用越来越广,但相比于其他癌症,肝癌形成强大的免疫耐受微环境使得肝癌患者长期处于免疫低应答状态,容易形成对肿瘤免疫治疗的抵抗性。因此,研究如何打破肝癌的免疫耐受,促进T细胞介导的抗肿瘤免疫应答有着重要的临床意义。2020年6月1日,肝病领域著名期刊《Hepatology》发表了中国科学院生物物理研究所杨鹏远课题组题为“Targeting Histone Deacetylase 6 Reprograms Interleukin-17-Producing Helper T Cell Pathogenicity and Facilitates Immunotherapies for Hepatocellular Carcinoma”的研究成果,揭示了靶向抑制组蛋白去乙酰化酶HDAC6能够特异性触发TH17细胞的效应功能,增强机体抗肝癌免疫应答,为肝癌患者的免疫治疗提供了新的思路和策略。该工作入选2020年《Hepatology》第6期封面论文。

[封面解读]:“特洛伊木马故事”,肝癌微环境(寓意城墙)具有极强的免疫抑制性。研究人员发现通过靶向HDAC6释放辅助性TH17细胞效应功能,能够打破并重塑肝癌免疫耐受微环境,促进杀伤性CD8+ T细胞浸润肿瘤并触发机体抗肝癌免疫应答。
TH17细胞是一群能够分泌IL-17A/F细胞因子、表达趋化因子受体CCR6和转录因子RoRγt的CD4+ 辅助性T细胞。它能够招募并活化肝脏内的免疫浸润,放大机体免疫监视能力。已有研究报道TH17细胞在过继转移治疗相关疾病中有着潜在的转化价值。但同时TH17细胞也具有可塑性,其能够在低水平TGF-β1诱导的情况下分化为“致病性”的TH17细胞,在高浓度TGF-β1会使其转分化为Tr1抑制性T细胞。由于肝癌微环境显著上调TGF-β1表达,促使TH17细胞的免疫效应功能受到抑制,甚至可能变成肝癌的“帮凶”。因此,研究TH17细胞的免疫效应机制对肝癌的临床治疗有着重要的科学意义。研究人员通过小鼠荷瘤实验发现,敲除肝癌细胞系中HDAC6基因不影响肝癌体内成瘤,但HDAC6敲除小鼠显著抑制肝癌皮下成瘤,这提示HDAC6主要通过免疫微环境来影响肝癌的进程。进一步实验证实,HDAC6敲除能够特异的诱导TH17细胞的分化及功能,并促进过继转移CD8+ T细胞的效应功能和肝癌清除能力。由于肝癌微环境能够形成强大的免疫耐受系统使得免疫检查点疗效受到极大的阻碍,研究人员发现靶向抑制HDAC6的TH17细胞能够很好的促进T细胞在肝癌中的浸润,并促进肝癌组织对anti-PD1抗体治疗的反应性。在分子机制上,胞浆定位的HDAC6直接对转录因子FoxO1赖氨酸K242位点进行去乙酰化修饰来维持FoxO1的入核及蛋白的稳定性。核转位的FoxO1能够直接功能上抑制TH17细胞转录因子RoRγt的活性,从而抑制TH17细胞的分化及效应功能。并且研究人员通过人源的TH17细胞证实了HDAC6-FoxO1信号调控机制在进化上是保守的。这些结果证明,在肝癌进程中HDAC6是连接免疫微环境和肝癌发生的重要调控因子,为肝癌肿瘤微环境的研究提供了新思路。
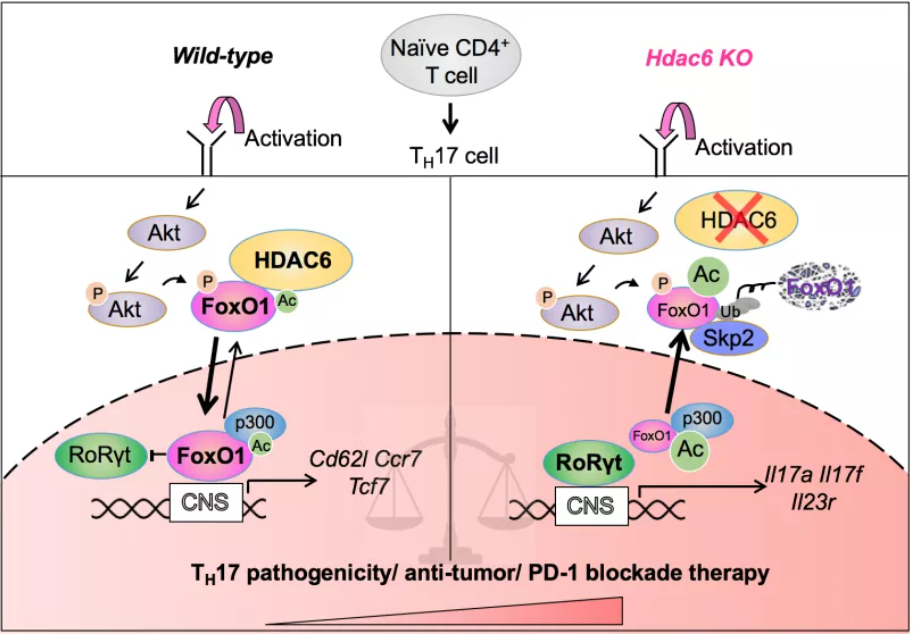
[机制示意图]:HDAC6通过对FoxO1蛋白的去乙酰化修饰促进FoxO1蛋白的核转位及蛋白稳定性从而抑制TH17细胞转录因子RoRγt的活性。当靶向抑制HDAC6能够重编程TH17细胞的免疫效应功能,促发机体的抗肿瘤能力及肝癌对anti-PD1抗体的反应,从而达到抑制肝癌进程的效果。
该工作由中国科学院生物物理研究所、清华大学生命科学学院、杜克大学和南京大学鼓楼医院多家单位合作完成。生物物理研究所感染与免疫重点实验室研究员杨鹏远教授为论文的通讯作者,杨鹏远课题组博士研究生邱伟楠为论文的第一作者。该研究得到科技部、国家自然科学基金委和中科院的经费支持。感谢深圳大学朱卫国课题组、厦门大学陈兰芬课题组、纪念斯隆-凯特琳癌症中心李明课题组、杜克大学李启靖教授、生物物理所王盛典研究员和杨福全研究员、生物物理所感染与免疫科研平台提供的帮助。文章链接:https://aasldpubs.onlinelibrary.wiley.com/doi/10.1002/hep.30960



