邵峰组Science报道细胞毒性淋巴细胞诱导细胞焦亡的机制
日期:2020-04-17 浏览次数:8197
文章来源:BioArt
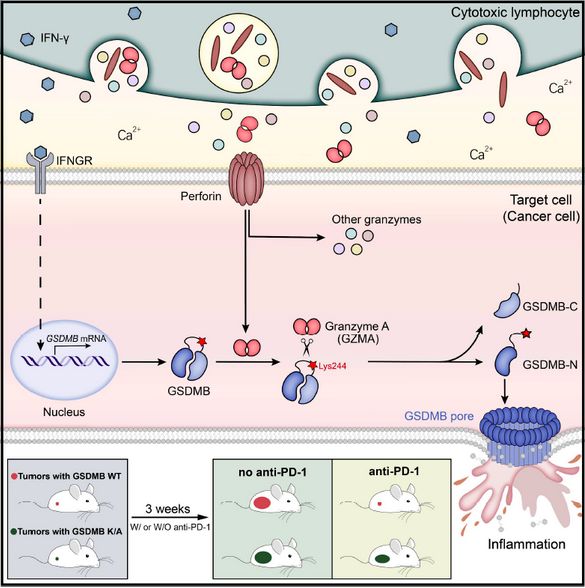
细胞焦亡(Pyroptosis)是近年颇受关注的炎症性细胞死亡类型。在早期研究中,因感染引起的细胞的炎症性死亡曾一度被误认为是细胞凋亡过程(Aptoptosis)。直到2001年,科研人员才关注由感染等引起的细胞死亡存在明显的炎性进展,且形态学上与传统的凋亡具有明显区别,将这一类细胞死亡命名为焦亡。但此后的十几年里,细胞焦亡一直被定义为由炎症性Caspase(Caspase-1/4/5/11)引起的细胞炎症性死亡。邵峰课题组在感染免疫和焦亡研究领域有突出贡献,其在2015年鉴定到焦亡的下游效应分子Gasdermin D(GSDMD)【1】,并解析了Gasdermin家族分子的功能【2】。在2017年,邵峰组在Nature报道Caspase-3可以水解Gasdermin E(GSDME)完成非感染性的细胞焦亡,将细胞焦亡的定义改写【3】。2018年,NCCD将焦亡修正为:一种依赖于Gasdermin家族蛋白形成质膜膜孔的可调控的细胞死亡(Regulated cell death),经常但并不总因炎症性Caspase的活化而完成。随后,其他课题组也发现Caspase-8也可引起细胞焦亡,并可影响炎症小体功能【4-7】关于细胞焦亡的研究进展极大的更新了我们对细胞死亡类型的理解,尤其是那些因时代和技术局限造成的错误认知。例如,在肿瘤治疗中,我们对化疗引起的正常组织损伤往往理解为凋亡,而这实际有很大一部分是由于GSDME活化产生的焦亡。细胞毒性淋巴细胞(如CTL细胞、NK细胞)是免疫系统重要的效应细胞,在识别靶细胞后通过释放穿孔素(perforin)和其他介质发挥杀伤作用。尽管淋巴细胞的杀伤功能已经有大量免疫学和细胞生物学研究,但目前对靶细胞的死亡类型仍普遍理解为细胞凋亡。2020年4月17日,邵峰课题组在Science发表题为“Granzyme A from cytotoxic lymphocytes cleaves GSDMB to trigger pyroptosis in target cells”的研究,再次更新了我们对焦亡的理解。他们发现,细胞毒性淋巴细胞(如CTLs,NK细胞等)中的丝氨酸蛋白酶Granzyme A可以经穿孔素(perforin)进入靶细胞,通过水解Gasdermin B(GSDMB)分子Lys229/Lys244位点诱导靶细胞发生焦亡。GSDMB存在组织特异性表达,并在消化系统上皮细胞源肿瘤细胞中呈高表达,而通过GSDMB诱导焦亡将增强抗肿瘤免疫,将成为这些肿瘤治疗潜在靶点。
邵峰课题研究人员最先关注是否淋巴细胞引起的细胞死亡具有焦亡特性,通过将NK细胞系(NK-92MI)与外源表达Gasdermin家族蛋白的293T细胞进行共培养,发现在表达了GSDMB的293T细胞较对照组呈现明显的焦亡特性。这种焦亡不受Pan-Caspase抑制剂zVAD的抑制,但在培养基中添加Ca2+粒子螯合剂EGTA(抑制穿孔素过程)和颗粒酶pan-granzyme抑制剂DCI可以抑制这种死亡。免疫印迹也证实GSDMB被水解为p30和p16两个片段。
通过表达筛选和体外水解验证,研究人员发现这种由NK细胞共培养引起的细胞死亡是由穿孔素中颗粒酶granzyme A(GZMA)引起,而其他颗粒酶(granzyme B/H/K/M)均无此效应。研究人员利用Edman测序找到水解位点位于Lys229和Lys244,并再次通过GSDMB K229A/K244A突变体证实以Lys244为主的水解介导了该型焦亡。
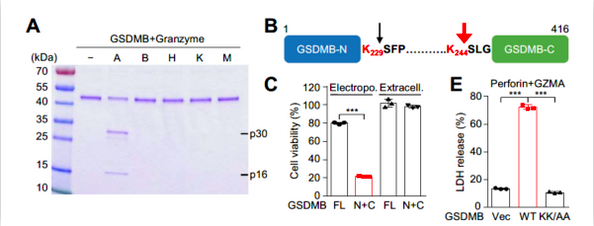
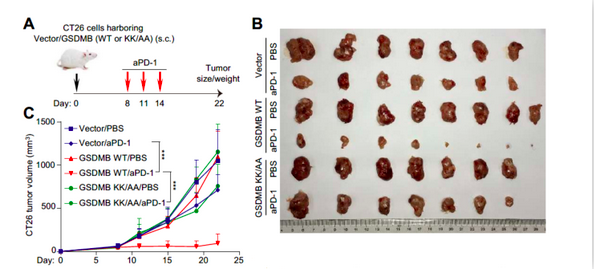
随后一系列敲低实验和内源实验等也证实这种细胞死亡类型的具体过程:GZMA经NK细胞释放的穿孔素进入靶细胞,通过水解靶细胞中GSDMB分子引起焦亡。这种过程极为特异:在颗粒酶中只有GZMA具有激活焦亡功能,而Gasdermin中也只有GSDMB可被GZMA水解。这项发现改写了焦亡只能经Caspase活化的定论,首次发现Gasdermin可在非Asp位点经丝氨酸蛋白酶GZMA水解执行打孔功能,并将经细胞毒性淋巴细胞诱导的细胞死亡认证为焦亡。在肿瘤免疫中,CTL细胞可通过释放穿孔素杀伤肿瘤细胞。研究人员随后以抗CD19 CAR-T细胞为模型证实,CAR-T细胞可通过GZMA诱导表达GSDMB的CD19+293T细胞发生焦亡。值得一提的是,在今年1月,黄波课题组也证实CAR-T细胞可以引起正常组织通过GSDME引起细胞焦亡,造成CAR-T疗法的副作用。这些进展也丰富了我们对CAR-T治疗效应的认识。肿瘤免疫中,以PD-1/PD-L1为主的免疫检查点治疗是当前的研究和应用热点。今年3月,刘志博和邵峰合作在Nature上报道通过诱导肿瘤组织内细胞焦亡可激活T细胞免疫,增强抗肿瘤功能【8】。在上个故事里,研究人员已经发现,穿孔素可以通过活化Caspase-3和GSDME引起焦亡,但使用Caspase抑制剂并不能完全扭转死亡表型,暗示也存在其他旁路引起焦亡。邵峰课题组在本研究中填补了这个故事。通过细胞系筛选,研究人员发现GSDMB在食管癌和胃癌细胞系中存在较高的表达,肿瘤组织中也发现消化系统上皮组织源肿瘤中GSDMB表达较高。TCGA数据中分析也可发现,在膀胱癌、皮肤黑色素瘤和肾透明细胞癌中GSDMB高表达患者预后较好。因小鼠中缺少GSDMB的表达,研究人员在CT26细胞中进行人源GSDMB-WT和K229A/K244A突变体的过表达和成瘤实验,发现与未过表达组相比,这两种表达株细胞在体内增殖中并未呈现明显的差异。但在辅以注射PD-1抗体后,种植了表达GSDMB-WT的小鼠肿瘤体积呈现明显减少,而K229A/K244A突变体株成瘤则未有明显变化。该实验证实,通过拮抗PD-1功能活化T细胞可增强其细胞毒性功能,诱导肿瘤细胞发生GSDMB介导的焦亡,而这种焦亡也进一步通过炎症特性激活了加强版的T细胞免疫。这一部分工作增强了焦亡在肿瘤治疗中的可能性。
总结来看,这项工作是邵峰课题组长期在焦亡领域耕耘的又一标志性成果,改写了焦亡仅通过Caspase活化的研究定论,在焦亡这一重要的细胞生物学事件中开拓了新的上游通路。邵老师在多次报告中曾提到,细胞死亡类型的并不由上游的切割的蛋白酶决定,而是下游的效应分子。过去近20年的研究只发现并拓展了一类上游蛋白酶(Caspase),这个故事颗粒酶GZMA也拉入焦亡family中。同时,本研究也更新了细胞毒性淋巴细胞诱导靶细胞的死亡类型的陈旧认知。我们可以试想,关于细胞死亡类型不可能只有凋亡和坏死这样简单的答案。随着研究工具和技术的丰富,未来会有更多死亡类型被还原真相。此外,邵峰课题组也在2020年开年的2-4月内先后在Cell、Nature和Science上实现大满贯(其实想想,大满贯本身没什么实际意义,工作solid,开辟新领域,更新认知才是最重要的)。祝贺邵峰老师,期待邵老师团队更多的突破性成果。
https://science.sciencemag.org/content/early/2020/04/15/science.aaz75481. SHI J, ZHAO Y, WANG K, et al. Cleavage of GSDMD by Inflammatory Caspases Determines Pyroptotic Cell Death[J]. Nature, 2015, 526(7575): 660–665. DOI:10.1038/nature15514.2. DING J, WANG K, LIU W, et al. Pore-Forming Activity and Structural Autoinhibition of the Gasdermin Family[J]. Nature, 2016, 535(7610): 111–116. DOI:10.1038/nature18590.3. WANG Y. Chemotherapy Drugs Induce Pyroptosis through Caspase-3 Cleavage of a Gasdermin[J]. Nature 6;547(7661):99-103: 20. . DOI:10.1038/nature223934.
ORNING P, WENG D, STARHEIM K, et al. Pathogen Blockade of TAK1 Triggers
Caspase-8–Dependent Cleavage of Gasdermin D and Cell Death[J]. Science, 2018, 362(6418): 1064–1069. DOI:10.1126/science.aau2818.5.
MUENDLEIN H I, JETTON D, CONNOLLY W M, et al. CFLIPL Protects
Macrophages from LPS-Induced Pyroptosis via Inhibition of Complex II
Formation[J]. Science (New York, N.Y.), 2020, 367(6484): 1379–1384. DOI:10.1126/science.aay3878.6.
FRITSCH M, GÜNTHER S D, SCHWARZER R, et al. Caspase-8 Is the Molecular
Switch for Apoptosis, Necroptosis and Pyroptosis[J/OL]. Nature, 2019[2019–11–23]. http://www.nature.com/articles/s41586-019-1770-6. DOI:10.1038/s41586-019-1770-6.7. NEWTON K, WICKLIFFE K E, MALTZMAN A, et al. Activity of Caspase-8 Determines Plasticity between Cell Death Pathways[J/OL]. Nature, 2019[2019–11–23]. http://www.nature.com/articles/s41586-019-1752-8. DOI:10.1038/s41586-019-1752-8.8. WANG Q. et al.A Bioorthogonal System Reveals Antitumour Immune Function of Pyroptosis. Nature . 2020 Mar;579(7799):421-426. doi: 10.1038/s41586-020-2079-1




