

杨辉/周海波等利用CasRx在神经性疾病治疗领域取得重大进展
日期:2020-04-09 浏览次数:7069
文章来源:BioArt
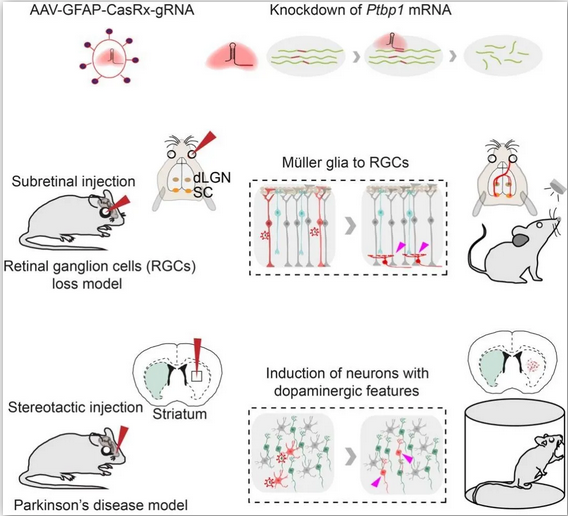
图注:(上)CasRx通过靶向的降解Ptbp1 mRNA从而实现Ptbp1基因表达的下调。(中)视网膜下注射AAV-GFAP-CasRx-Ptbp1可以特异性的将视网膜穆勒胶质细胞转分化为视神经节细胞,转分化而来视神经节细胞可以和正确的脑区建立功能性的联系,并且提高永久性视力损伤模型小鼠的视力。(下)在纹状体中注射AAV-GFAP-CasRx-Ptbp1可以特异性的将星形胶质细胞转分化为多巴胺神经元,从而基本消除了帕金森疾病模型小鼠的运动症状。
原文链接:https://doi.org/10.1016/j.cell.2020.03.024
参考文献
1、Konermann, S., Lotfy, P., Brideau, N. J., Oki, J., Shokhirev, M. N., & Hsu, P. D. (2018). Transcriptome engineering with RNA-targeting type VI-D CRISPR effectors. Cell, 173(3), 665-676.
2、He, B., Peng, W., Huang, J., Zhang, H., Zhou, Y., Yang, X., ... Yang, H. & Peng, H. (2020). Modulation of metabolic functions through Cas13d-mediated gene knockdown in liver. Protein & Cell, 1-7.
3、Xue, Y., Ouyang, K., Huang, J., Zhou, Y., Ouyang, H., Li, H., ... & Fu, X. (2013). Direct conversion of fibroblasts to neurons by reprogramming PTB-regulated microRNA circuits. Cell, 152(1-2), 82-96.