

严景华/齐建勋首次发现新冠病毒进入细胞的详细分子细节
日期:2020-03-25 浏览次数:8877
来源:iNature
由于新病例的迅速增加,2019年冠状病毒病(COVID-19)很快引起了全球关注。新型冠状病毒感染被认为是从动物传播的,到2020年1月,怀疑最初受感染的患者是通过人与人之间的传播感染了该病毒。自2020年1月以来,该病毒已迅速传播到中国大部分地区和其他国家。截至2020年3月24日,全球报告了332930例确诊的COVID-19和14510例死亡人数。这些数字每天都会更新,而且预计还会进一步增加。到现在为止,SARS-CoV-2 S蛋白中负责hACE2相互作用的区域仍然未知。
值得注意的是,一组单克隆抗体(mAbs)以及针对SARS-S1 / RBD的鼠多克隆抗血清无法与SARS-CoV-2 S蛋白结合,表明SARS-CoV和SARS-CoV-2之间的抗原性存在显着差异,表明先前开发的基于SARS-RBD的候选疫苗不太可能对SARS-CoV-2预防有任何临床益处。综上所述,这些数据阐明了病毒的进入和致病机理,并有望激发针对这种新兴病原体的新型靶向治疗。
由于新病例的迅速增加,2019年冠状病毒病(COVID-19)很快引起了全球关注。新型冠状病毒感染被认为是从动物传播的,到2020年1月,怀疑最初受感染的患者是通过人与人之间的传播感染了该病毒。自2020年1月以来,该病毒已迅速传播到中国大部分地区和其他国家。截至2020年3月24日,全球报告了332930例确诊的COVID-19和14510例死亡人数。这些数字每天都会更新,而且预计还会进一步增加。
据报道,冠状病毒是非分段的正义RNA病毒,主要在鸟类和哺乳动物中引起动物感染,并已证明对人类具有致命的杀伤力。已知这些病毒具有四种结构蛋白,包括E,M,N和S蛋白。 冠状病毒感染性的主要决定因素是S蛋白,它与宿主细胞上的膜受体结合,介导病毒和细胞膜融合。血管紧张素转换酶2(ACE2)是ACE的同系物,是宿主细胞细胞膜上的重要受体之一。S蛋白和ACE2的相互作用促进了宿主细胞的SARS-CoV入侵。SARS-CoV-2 S蛋白的结构与SARS-CoV S蛋白的结构高度相似,并且SARS-CoV-2 S蛋白以比SARS-CoV S蛋白更高的亲和力与ACE2结合,表明SAR-CoV-2 具有更强的侵袭能力。
据报道,冠状病毒是非分段的正义RNA病毒,主要在鸟类和哺乳动物中引起动物感染,并已证明对人类具有致命的杀伤力。已知这些病毒具有四种结构蛋白,包括E,M,N和S蛋白。 冠状病毒感染性的主要决定因素是S蛋白,它与宿主细胞上的膜受体结合,介导病毒和细胞膜融合。血管紧张素转换酶2(ACE2)是ACE的同系物,是宿主细胞细胞膜上的重要受体之一。S蛋白和ACE2的相互作用促进了宿主细胞的SARS-CoV入侵。SARS-CoV-2 S蛋白的结构与SARS-CoV S蛋白的结构高度相似,并且SARS-CoV-2 S蛋白以比SARS-CoV S蛋白更高的亲和力与ACE2结合,表明SAR-CoV-2 具有更强的侵袭能力。

在冠状病毒中,进入过程是由包膜包埋的表面定位棘突糖蛋白介导的。在大多数情况下,该S蛋白会被宿主蛋白酶裂解为分别负责受体识别和膜融合的S1和S2亚基。S1可以进一步分为N末端结构域(NTD)和C末端结构域(CTD),两者都可以充当受体结合实体【例如SARS-CoV和MERS-CoV都利用S1 CTD 识别受体(也称为受体结合结构域,RBD)】,而小鼠肝炎冠状病毒将其S1 NTD与受体结合。到现在为止,SARS-CoV-2 S蛋白中负责hACE2相互作用的区域仍然未知。
在这项研究中,研究人员利用免疫染色和流式细胞仪检测,首先确定S1 CTD(SARS-CoV-2-CTD)为SARS-CoV-2中与hACE2受体相互作用的关键区域。随后解决了与hACE2结合的SARS-CoV-2-CTD的2.5Å晶体结构,该结构揭示了总体上与SARS-CoV RBD(SARS-RBD)相似的受体结合模式。但是,与SARS-RBD相比,SARS-CoV-2-CTD与hACE2形成更多的原子相互作用,这与更高的受体结合亲和力数据相关。
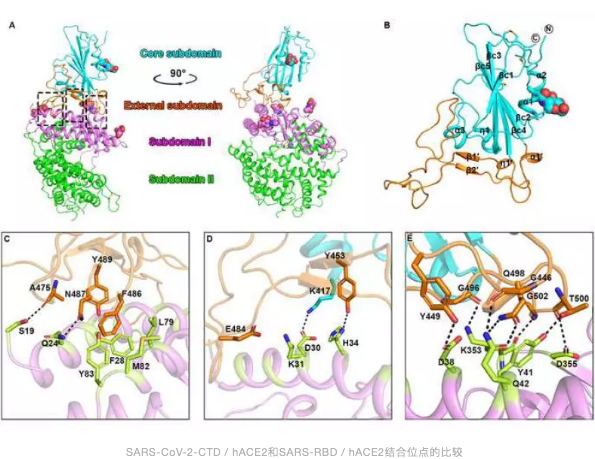
值得注意的是,一组单克隆抗体(mAbs)以及针对SARS-S1 / RBD的鼠多克隆抗血清无法与SARS-CoV-2 S蛋白结合,表明SARS-CoV和SARS-CoV-2之间的抗原性存在显着差异,表明先前开发的基于SARS-RBD的候选疫苗不太可能对SARS-CoV-2预防有任何临床益处。综上所述,这些数据阐明了病毒的进入和致病机理,并有望激发针对这种新兴病原体的新型靶向治疗。
参考消息: