Protein & Cell | 刘君/何川团队揭示METTL14非依赖于甲基化转移酶的染色质调控新功能
日期:2023-03-01 浏览次数:21218
来源:BioArt
可逆性RNA甲基化修饰多层级调控RNA生成、加工代谢等重要生物功能的发现,为表观调控提供了全新视角,引起了人们广泛关注。其中,N6-甲基腺嘌呤(m6A)是真核生物mRNA上最丰富的修饰。METTL3和METTL14是m6A甲基转移酶复合物的核心组分,它们形成异源二聚体,催化RNA形成甲基化修饰。近年来,有研究成果表明在一些生物体系中, METTL14敲除会导致更严重于METTL3敲除的表型,推测METTL14可能具有独立于METTL3和m6A甲基化的调控功能,但具体的调控机制尚不明确。
2023年2月23日,北京大学刘君研究员团队和美国芝加哥大学何川教授组在Protein & Cell在线发表了题为METTL14 is a chromatin regulator independent of its RNA N6-methyladenosine methyltransferase activity 的研究长文(Research Article)。这项工作揭示了METTL14非依赖于METTL3和m6A的对于异染色质和RNA转录的新型调控机制,以及这种调控功能在小鼠胚胎干细胞(embryonic stem cell, ESC)干性维持和分化中的重要作用。
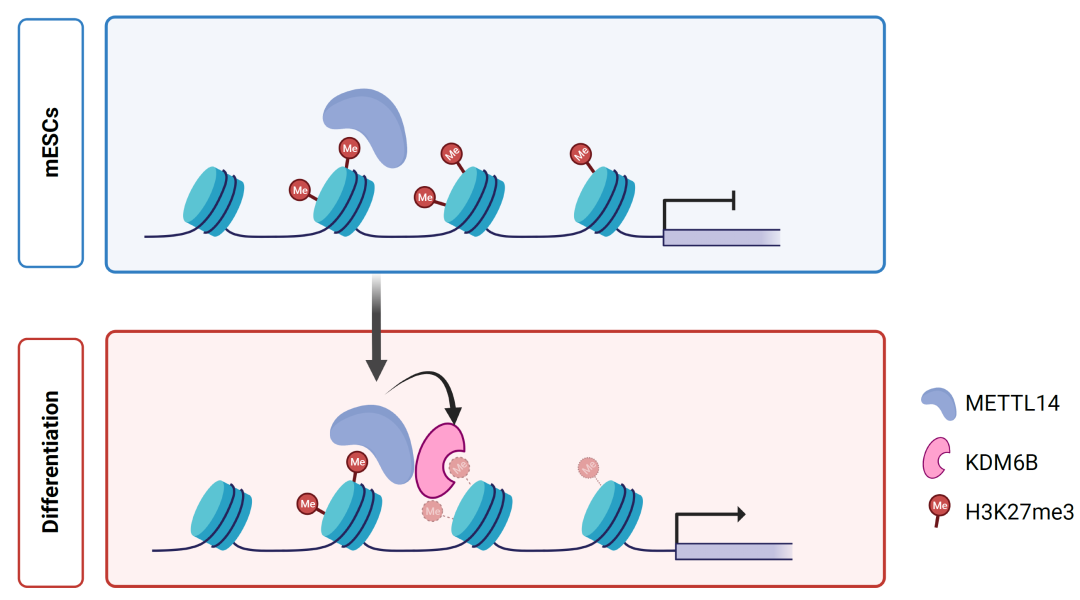
该文作者首先发现在小鼠ESC中敲除METTL3和METTL14蛋白会造成明显差异的表型:METTL3敲除小鼠ESC的集落形态不变,而METTL14敲除则会影响其干性状态维持。深入分析显示,这两种蛋白敲除均会造成相似程度的全局性m6A甲基化水平下调。然而,与敲除METTL3引起的转录上调相反,敲除METTL3呈现整体RNA转录水平抑制,这表明METTL14可能在基因转录调控中具有非依赖于METTL3和m6A的功能。通过整合分析这两种蛋白在基因组上的结合与不同表观遗传修饰之间的相关性,本文作者发现METTL14的分布和异染色质修饰H3K27me3位点呈现较强的共定位,而METTL3则更倾向于分布在一些常染色质区域。进一步研究发现,METTL14敲除会导致H3K27me3的总体水平上调,METTL14识别H3K27me3并募集KDM6B对其进行去甲基化,从而参与调控H3K27me3在小鼠ESC中的水平维持。已有研究表明小鼠ESC分化过程中H3K27me3起到了关键的调控作用。研究者最后表明METTL14对H3K27me3的这种调控作用在小鼠ESC干性维持和分化过程中发挥了重要功能,使用H3K27me3甲基转移酶抑制剂成功回补了METTL14敲除所导致的小鼠ESC在转录和状态方面的影响。
该研究揭示了METTL14独立于m6A的在染色质和基因转录调控方面的新功能。这项工作也提示了可能存在更多的RNA表观遗传修饰调控因子独立于甲基化的调控机制,为后续多种生物过程中的RNA修饰相关调控因子功能的研究提供了新的视角和思路。
芝加哥大学豆晓阳博士、北京大学研究生黄露露和芝加哥大学肖雨博士为本文的共同第一作者。北京大学刘君研究员和芝加哥大学何川教授为本文的共同通讯作者。该工作还受到约翰霍普金斯大学医学院Shuying Sun助理教授、同济大学高亚威教授和南京医科大学沈彬教授及其团队成员的支持与合作。
原文链接:https://doi.org/10.1093/procel/pwad009


