

徐涛/纪伟/郭强合作开发出荧光靶向的冷冻原位结构分析样品减薄系统
日期:2023-01-17 浏览次数:23454
所谓眼见为实,在原位研究细胞内分子机器与超微结构,解析其复杂精密的组装结构与生理功能之间的关系,是生命科学的前沿热点。冷冻电子断层扫描成像(cryo-ET)是目前主要的原位研究技术,但受电子束穿透能力限制,需要将细胞和组织样品减薄成200纳米左右的薄片后成像。
低温聚焦离子束(cryo-focused ion beam, cryo-FIB)减薄是近年来发展出的主流冷冻生物样品制备技术,FIB通过搭载在冷冻扫描电镜上,与冷冻样品传输系统一起,形成冷冻双束扫描电镜系统,实现为cryo-ET制备冷冻切片样品。然而cryo-FIB减薄存在一个难以克服的技术瓶颈,无法针对细胞内部的特定目标进行定点减薄,只能通过随机加工,保留约200纳米厚的切片样品。该技术对细胞内丰度较高的研究目标(如核糖体等)来说已经比较成熟,但对于丰度较低的研究目标(如中心体等),还存在较大的挑战。
近年来发展的光电融合成像技术(correlative light and electron microscopy,CLEM)可以弥补电镜成像无法特异性识别研究目标的缺陷,CLEM利用荧光成像来表征和定位特定的研究对象,再通过光电图像的配准确定研究对象在电镜图像上的位置,用来引导FIB的定点切割。然而传统的引导冷冻样品减薄的CLEM技术,往往是通过将冷冻样品在冷冻荧光显微镜和冷冻双束电镜之间传输,以实现导航减薄功能,这种分体式荧光导航减薄技术操作复杂,精度低,样品在多次转移中容易受到冰污染、升温或者损坏。而目前整合了荧光显微镜、聚焦离子束和扫描电镜的一体化商业设备,荧光成像均为宽场成像,无法提供精确三维导航定位信息。长期以来,低效率、低成功率的样品制备成为cryo-ET技术的一个难题,也成为限制其应用范围的一个重要因素。
为了解决这一技术瓶颈,中国科学院生物物理研究所徐涛院士组和纪伟组联合北京大学郭强团队,研制出集成式冷冻光电融合聚焦离子束系统(cryogenic correlated light, ion and electron microscopy,cryo-CLIEM)。这套系统将激光共聚焦显微镜集成到商业化双束电镜中,成功实现了双束电镜内冷冻三维多色荧光成像,并设计了基于冷冻电镜多样品杆的独特冷冻样品传输方案,以便捷高效地开展靶向样品减薄制备。
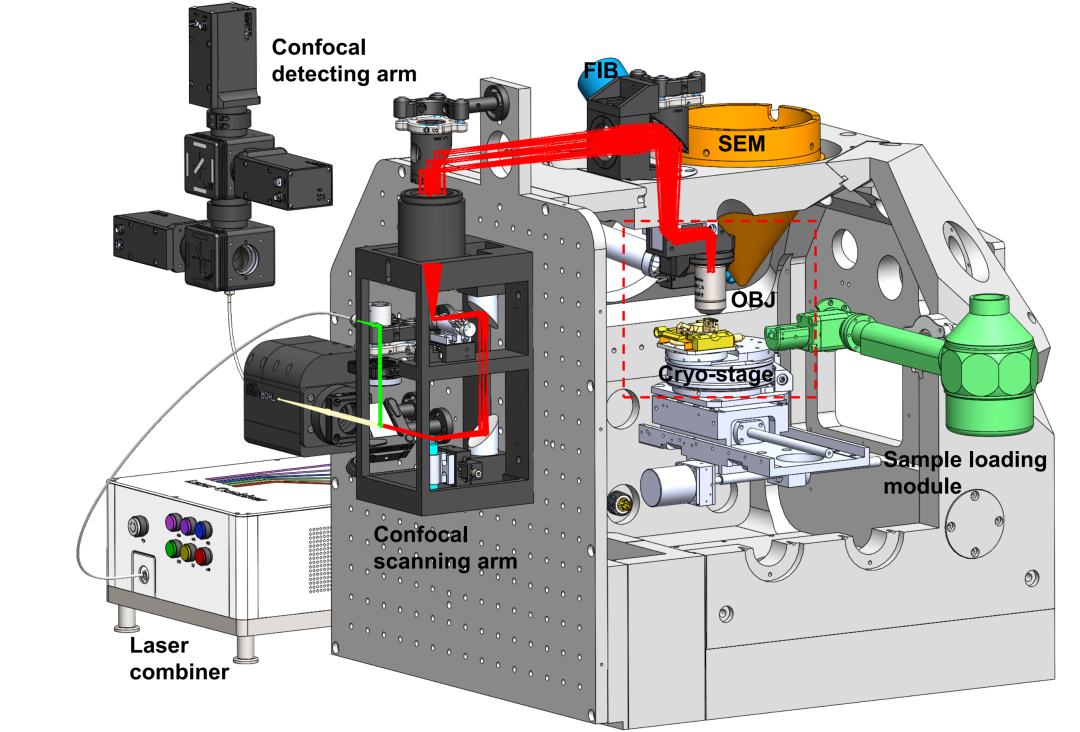
图1:CLIEM系统设计图。
在此设备基础上,研究团队还开发了基于刻蚀图像的配准方法,利用三维光学成像发展了全新荧光导航FIB减薄流程,并首次提出“虚拟切片”概念,巧妙地利用三维图像投影方法,生成FIB切割角度对应的二维光学图像,可直接与FIB图像进行配准关联,不再需要传统光电融合成像常用的配准标记物(fiducial marker)和复杂的坐标变换,显著提高了荧光导航FIB减薄的效率和成功率。
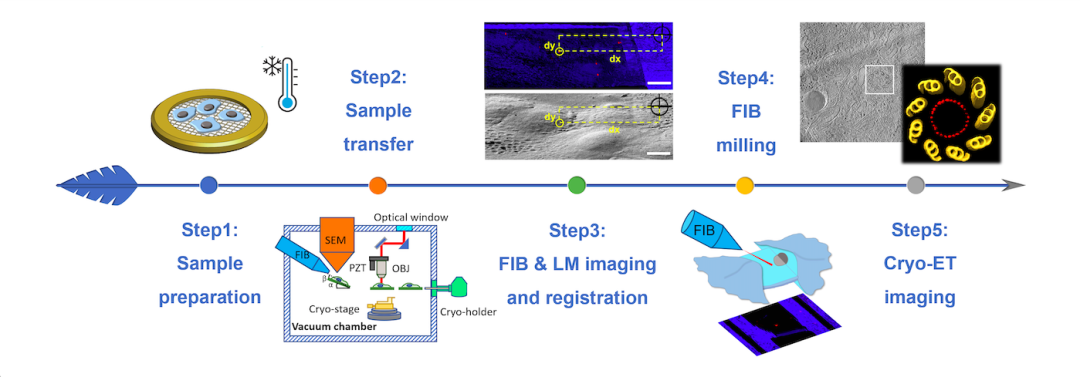
图2:CLIEM实验流程示意。
利用CLIEM系统,研究团队进行了多种细胞结构的定点减薄和原位成像研究,包括利用荧光标记了HepG2细胞中脂滴-线粒体的互作位点,并利用CLIEM系统的“虚拟切片”功能,找到了含有丰富互作结构的最优切割位置,并在此位置精准制备了冷冻细胞切片。借助cryo-ET,团队实现了脂滴-线粒体互作位点的原位成像,在互作面上发现了丰富的连接丝。此外,团队还利用内质网-线粒体互作位点对系统进行了验证。
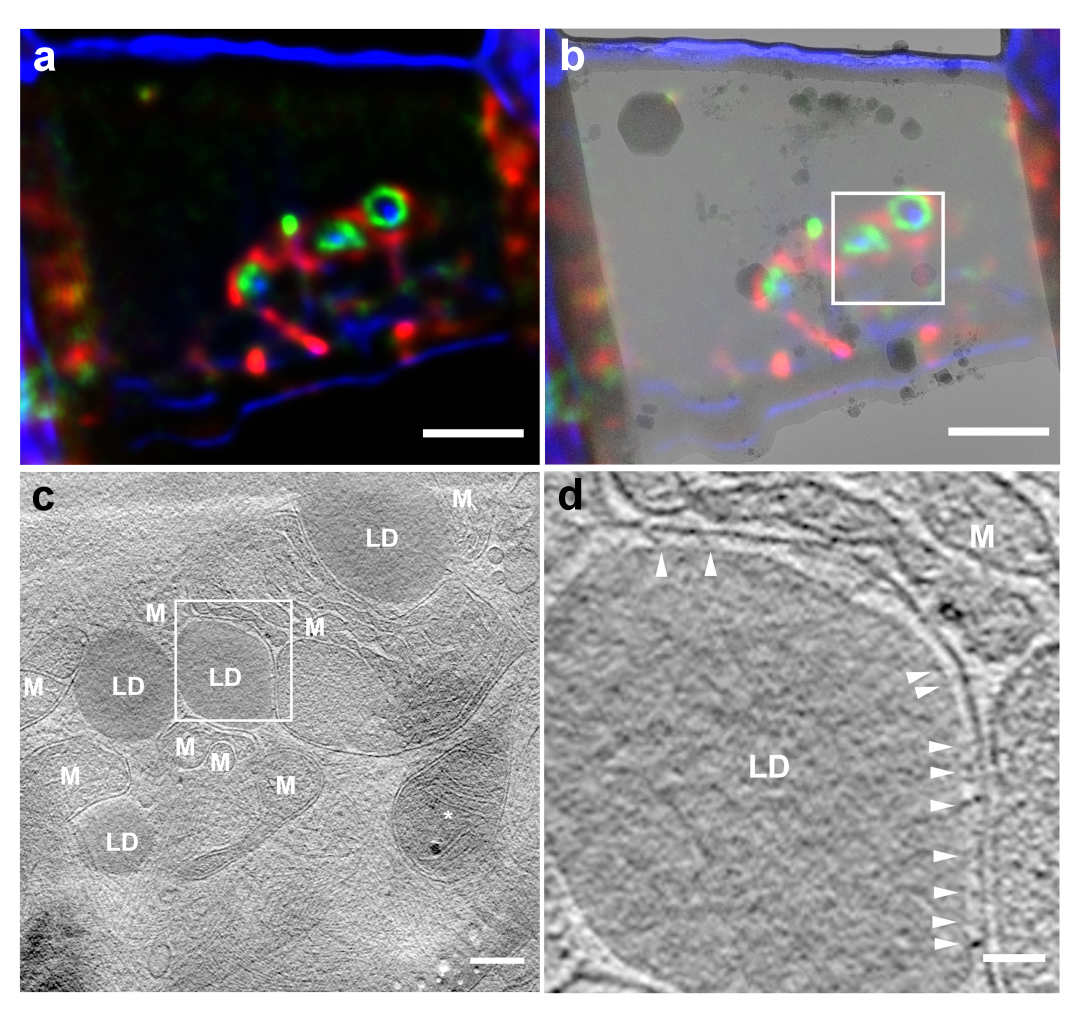
图3: HepG2细胞线粒体-脂滴互作位点的原位研究。(a)FIB减薄切片的多色光镜图。绿色标记线粒体-脂滴互作位点,红色标记线粒体,蓝色为明场。(b)切片光镜图像和透射电镜图像的关联图像。白框标记cryo-ET数据收集范围。(c)Cryo-ET三维重构图像,可清晰识别线粒体(M)和脂滴(LD)。(d)c中白框部分的局部放大图,可识别线粒体和脂滴互作面上的丝状连接结构(箭头)。Scale bars:a,b,2 μm;c,200 nm;d,50 nm。
此外,团队还实现了中心粒样品的高效制备和原位成像。利用CLIEM的高精度定点切割,制备了含有中心粒的冷冻HeLa细胞切片,并利用荧光导航定位引导cryo-ET进行数据收集,发现中心粒内部由27个点状密度形成的圆环结构。

图4: HeLa细胞中心粒的原位成像研究。(a)含有中心粒(方框)的cryo-ET三维重构图像。(b)中心粒及其周围结构的分割渲染图。(c)a中方框部分的局部放大图。(d)中心粒的三维结构建模。Scale bars:a,200 nm;b inset 10 nm;c,50 nm。
综上,CLIEM不仅可以在拥挤的细胞环境中精确识别最佳切割位点,还可对孤立细胞事件进行精准切割,可广泛应用于各种细胞器、生物大分子复合物、病毒等研究对象的定点减薄,为精准制备cryo-ET样品提供了新的高效解决方案,有助于推动原位细胞生物学的发展。
上述研究成果以“Integrated multimodality microscope for accurate and efficient target-guided cryo-lamellae preparation”为题,于2023年1月16日在Nature Methods杂志上,与中国科学院生物物理所孙飞课题组和蛋白质科学研究平台生物成像中心团队发展的ELI-TriScope技术背靠背发表。中国科学院生物物理所徐涛院士、纪伟研究员和北京大学郭强研究员为该论文共同通讯作者,中国科学院生物物理所李尉兴、卢婧、肖珂和广州实验室周茂阁为共同第一作者。
该工作受到国家重点研发计划、国家自然科学基金委、中国科学院战略性先导科技专项(B类)"生物大分子复合体结构与功能的跨尺度研究"等资助,得到孙飞研究员、刘平生研究员、章新政研究员,以及北京大学陈建国教授、中国科学院遗传与发育生物学研究所何康敏研究员的支持与建设性意见。样品制备、数据收集和分析等工作得到生物物理所蛋白质科学研究平台生物成像中心相关工作人员的支持和帮助。