

冯巍课题组和徐涛课题组合作揭示膜融合调控相关Mint1-Munc18-1-syntaxin-1复合物组装的分子机制
日期:2023-01-09 浏览次数:24109
来源:大屯路15号
囊泡转运过程中的膜融合是真核细胞生命活动中的关键生物学过程,受多种蛋白质及其复合物的精细调控。SNARE复合物是介导膜融合的核心蛋白质分子机器,由SNARE蛋白组装而成。SNARE蛋白是一种进化上保守的膜锚定蛋白家族,含有一个由60~70个氨基酸残基组成的保守区域,称为SNARE-motif。发生膜融合时,四个SNARE-motif相互识别和结合,形成一个高度稳定的α-螺旋束结构,类似“拉链”一样(SNARE-“ZIPPER”),将两种膜拉近并驱动膜融合。
中国科学院生物物理研究所冯巍课题组与徐涛课题组针对该科学问题开展合作研究。首先,通过生化手段鉴定了Mint1和Munc18-1的相互作用位点,发现Mint1的MID结构域(Mint1-MID)中一段富含酸性氨基酸的无序区域与Munc18-1直接结合。随后,利用X-射线晶体学解析了Mint1-MID-Munc18-1-syntaxin-1复合物的结构,发现Mint1-MID和syntaxin-1分别结合在Munc18-1拱桥形结构的两个相对的结合位点。在复合物结构中,闭合构象的syntaxin-1结合在Munc18-1结构域1和3a围成的中央腔室;Mint1-MID形成一段短的螺旋结构,该螺旋的疏水氨基酸直接插入Munc18-1中央腔室背面结构域3b形成的疏水口袋中,而该疏水口袋周围富含碱性氨基酸,恰好与Mint1-MID中的酸性氨基酸形成电荷互补。Mint1-MID和Munc18-1相互作用界面上关键氨基酸的突变,直接影响两者的结合,破坏Mint1-Munc18-1-syntaxin-1复合物组装。综上所述,该研究阐明了Mint1与Munc18-1、 syntaxin-1的相互作用关系及其复合物组装的分子机制,揭示了Mint1作为重要支架蛋白识别Munc18-1并将其招募到质膜参与调控膜融合的作用机制。研究成果以“A non-canonical target-binding site in Munc18-1 domain 3b for assembling the Mint1-Munc18-1-syntaxin-1 complex”为题,于2023年1月5日发表在 Structure 杂志上。
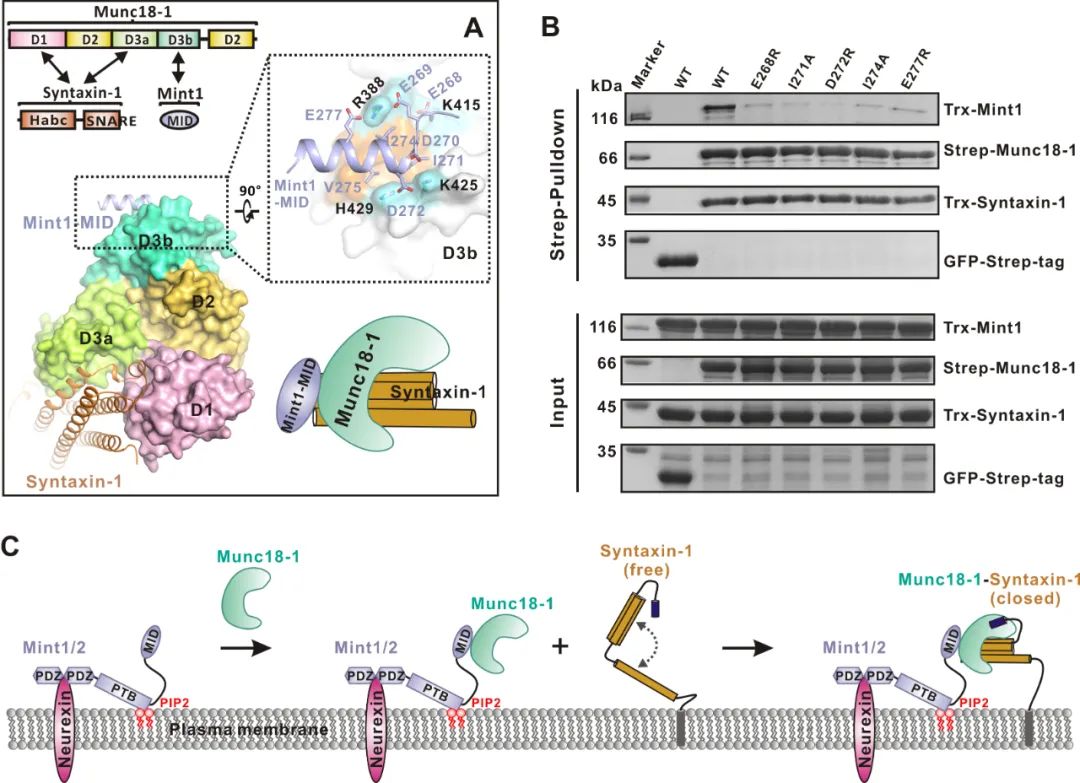
图示:膜融合调控相关Mint1-Munc18-1-syntaxin-1复合物组装的分子机制
中国科学院生物物理研究所冯巍研究员与徐涛课题组的宋婀莉研究员为本文的通讯作者。冯巍课题组李薇博士、徐涛课题组博士研究生邢莹和冯巍课题组博士研究生王悦为本文的共同第一作者。该研究得到国家重点研发计划、中科院战略性先导科技专项(B)以及国家自然科学基金等基金的资助。
文章链接:https://doi.org/10.1016/j.str.2022.11.002