Protein & Cell:许敏/代绍兴/左大明/袁硕峰合作揭示hnRNPA2B1的首个激动剂PAC5抗HBV和SARS-CoV-2体内活性的新机制
日期:2022-07-20 浏览次数:4731
来源:BioArt
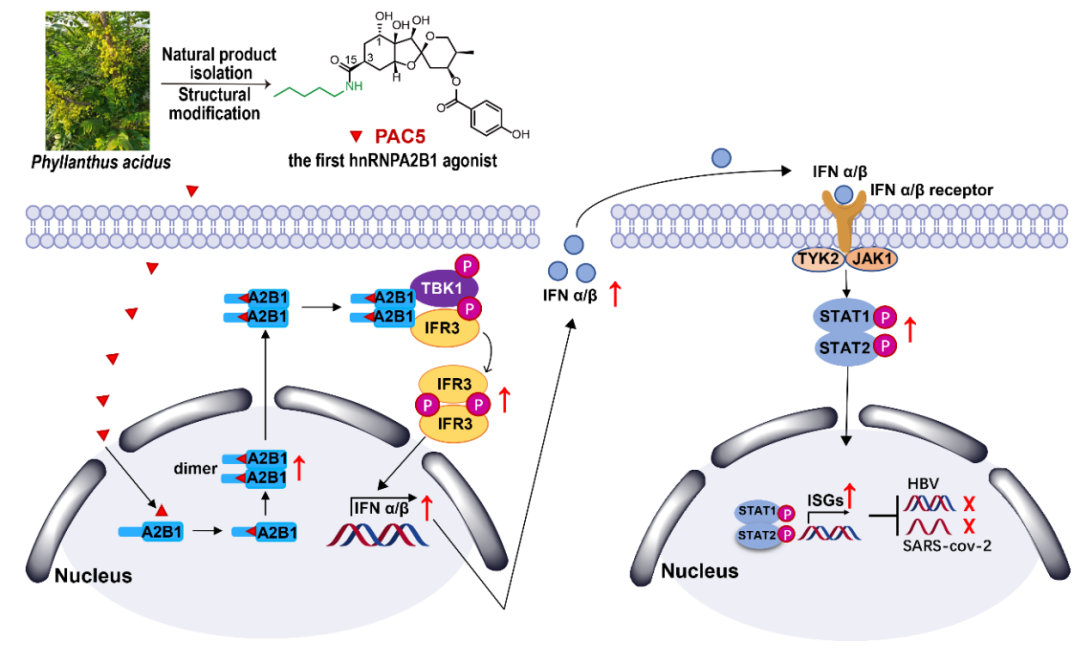
新发和反复爆发的病毒性疾病是一个严重的公共卫生问题。历史上,乙型肝炎病毒 (HBV) 已夺去数百万人的生命。目前,COVID-19大流行已造成巨大的经济损失和数百万人死亡【1,2】。乙型肝炎是一种慢性病毒性疾病,其主要挑战是消除HBV共价闭合环状DNA (cccDNA),减少乙型肝炎表面抗原 (HBsAg) 【3】。而COVID-19的主要挑战是具有免疫逃逸能力的SARS-CoV-2遗传变异体,特别是Delta (B.1.617.2)和Omicron (B.1.1.529)【4,5】。目前,抗HBV和SARS-CoV-2的临床药物属于直接作用型抗病毒药物 (DAAs)。例如,治疗慢性HBV的核苷类似物靶向病毒DNA聚合酶【3】,治疗COVID-19的Remdesivir和molnupiravir针对病毒RNA聚合酶,paxlovid针对病毒的蛋白酶 (Mpro) 【6,7】。然而,DAAs药物易发生耐药性。因此,发现具有广谱抗病毒活性的、宿主靶向的新颖化合物(HDAs)对于慢性和急性病毒疾病至关重要。2022年7月15日,昆明理工大学生命科学与技术学院许敏课题组联合灵长类转化医学研究院代绍兴课题组、南方医科大学左大明课题组和香港大学袁硕峰课题组在Protein & Cell上发表研究成果 A hnRNPA2B1 agonist effectively inhibits HBV and SARS-CoV-2 Omicron in vivo ,首次发现新型临床前小分子PAC5可作为新靶标hnRNPA2B1 (heterogeneous nuclear ribonucleoprotein A2B1) 的激动剂。通过激活靶标蛋白hnRNPA2B1进而激活TBK1-IRF3信号通路,抑制了体内乙肝病毒(HBV)和新型冠状病毒(CoV-19)感染。云南丰富的中药(民族药)用经验驱动药物资源分子发现。这些药物资源分子结构骨架丰富,生物活性多样,是连接靶标大分子与疾病的天然桥梁,在当今交叉学科的发展中扮演着无以替代的角色。它们能可逆性的、可控性的调控相应的生物学变化。因此,以这些药物资源分子为引导,研究新的作用机制和新的生物学或药学靶点分子及新的信号转导通路,加快原始创新药物的发现具有非常重要的科学和战略意义。昆明理工大学许敏教授研究团队长期致力于云南省民族药中药物资源分子的高效发现和识别,并以此为探针分子,揭示靶标蛋白及其作用机制,推进云南丰富的民族民间天然药物资源转化为创新药物。该研究论文从云南省傣族抗乙肝病毒药物叶下珠中发现并基于构效优化合成了一种抗病毒天然新型倍半萜衍生物PAC5。该分子能够消除HBV共价闭合环状DNA(cccDNA),并降低大抗原载量,即乙型肝炎表面抗原(HBsAg),有望突破慢性病毒性疾病HBV感染的临床治疗中的瓶颈问题。引人注目的是,口服PAC5显著改善了仓鼠模型中SARS-CoV-2感染引起的肺损伤,并显著抑制了病毒感染。
进一步通过生物素探针和荧光探针证明PAC5结合hnRNPA2B1是治疗HBV和SARS-CoV-2感染的新药物靶点。hnRNPA2B1是病原体DNA的核传感器,在抗病毒先天免疫反应中起着至关重要的作用,具有非常重要的生物学功能。
该研究论文首次证明了hnRNPA2B1在广谱抗病毒治疗中的成药性。并发现了一种新的机制,当PAC5结合的hnRNPA2B1被激活,二聚并转移到细胞质上时,它会激活TBK1-IRF3途径,导致I型干扰素(IFN)的产生。随后,STAT1/2的磷酸化增强,激活干扰素刺激基因(ISGs)表达发挥抑制病毒感染作用。PAC5将开发为新一代的宿主靶向的广谱抗病毒药物(HDAs)。目前正在引入外部资本,以期加快推进PAC5抗病毒1类原始创新药的临床转化。
该项研究由昆明理工大学、南方医科大学、香港大学和格里菲斯大学等机构合作完成。南方医科大学左大明教授和博士研究生陈宇,香港大学蔡建飘为并列第一作者。昆明理工大学生命科学与技术学院伍俊琪硕士研究生、罗佳硕士研究生和袁浩洋硕士研究生承担了该文章的部分工作。昆明理工大学为第一单位,昆明理工大学生命科学与技术学院许敏教授为主要通讯作者。灵长类转化医学研究院代绍兴副教授,南方医科大学左大明教授和香港大学袁硕峰教授为论文的共同通讯作者。
原文链接:https://doi.org/10.1093/procel/pwac027
参考文献:
1. Ledford, H., Can drugs reduce the risk of long COVID? What scientists know so far. Nature (London, U. K.), 2022. 604(7904): p. 20-21.2. Sleigh, A., Twenty-first century plague: The story of SARS. Nature, 2005. 435(7044): p. 886-887.3. Fanning Gregory, C., et al., Therapeutic strategies for hepatitis B virus infection: towards a cure. Nat Rev Drug Discov, 2019. 18(11): p. 827-844.4. Tao, K.M., et al., The biological and clinical significance of emerging SARS-CoV-2 variants. Nature Reviews Genetics, 2021. 22(12): p. 757-773.5. Planas, D., et al., Considerable escape of SARS-CoV-2 Omicron to antibody neutralization. Nature, 2022. 602(7898): p. 671-+.6. Wahl, A., et al., SARS-CoV-2 infection is effectively treated and prevented by EIDD-2801. Nature, 2021. 591(7850): p. 451-+.7. Owen, D.R., et al., An oral SARS-CoV-2 M-pro inhibitor clinical candidate for the treatment of COVID-19. Science, 2021. 374(6575): p. 1586-+.


