Protein & Cell: CRISPR基因编辑技术实现100%产生雌性后代小鼠
日期:2022-03-30 浏览次数:2825
来源:BioArt
相信大家都十分讨厌蚊子,被蚊子叮咬后不仅瘙痒难耐,而且容易传染疾病。众所周知,只有母蚊子才会叮咬和传播疾病,通过改变性别控制蚊子种群进行病媒防治极为有效。除此之外,随着经济的快速发展,人们对肉、奶、蛋等的品质及需求量剧增,控制畜禽性别来快速定向繁殖,可以更好的满足迅速增长的社会需求,对畜禽生产有着十分重要的意义和经济价值。对科学研究来说,就更不用说了。像生殖系统、卵巢癌、前列腺癌等相关研究,需要大量某一特定性别的实验动物,而另一种性别动物的只能等着“被处理”。
目前,主要可以通过前期精液筛选,或通过基因编辑技术作用某个致死基因在胚胎发育的早期阶段杀死特定性别的胚胎来实现性别控制。由于半数后代在早期胚胎阶段就被淘汰,产仔数也就只有接近正常数量的一半,从而影响出生率,一定程度上增加了时间和经济成本。
2022年3月25日,华东师范大学生命科学学院的吴宇轩教授在Protein & Cell 在线发表了题为:Gonadal mosaicism mediated female-biased gender control in mice的研究论文,运用CRISPR基因编辑技术在精子发生过程中实现性别选择,100%产生雌性后代小鼠。
该研究以小鼠为模型,利用CRISPR基因编辑技术在精原干细胞(Spermatogonial stem cells, SSCs)中特异性靶向Y染色体重复序列,而不是通过CRISPR/Cas9在胚胎阶段作用特定基因,在精子发生过程中消除携带Y染色体的生精细胞,通过这种策略实现了100%产生雌性小鼠后代,且产仔量不受影响。
研究团队建立了一个在SSC中特异性表达Cas9蛋白 (Hspa2::Cas9),并且同时表达以Y染色体重复序列为靶点的向导RNA(single guide RNA,sgRNA)的小鼠系。在该小鼠雄性个体中,携带Y染色体的SSC在精子发生过程中就被消除,当与正常雌性小鼠交配后,产生的后代100%为雌性小鼠,且生产总数量不受影响。
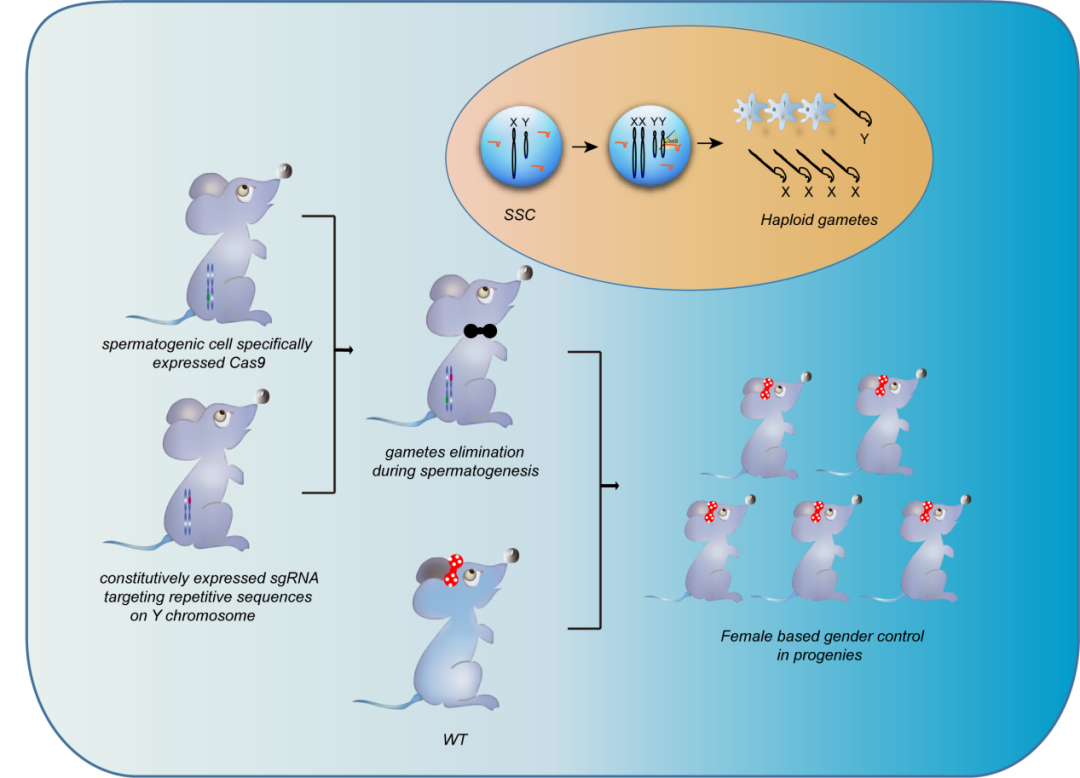
在mESCs中,研究团队发现CRISPR/Cas9介导靶向重复序列,诱导的DNA双链断裂引发了DNA损伤反应,并导致P53依赖的细胞死亡,从而实现了小鼠在精子发生过程中携带Y染色体生精细胞的消除。这项工作丰富了小鼠性别控制研究的理论基础,并为进一步的进化干预和人工繁殖的相关研究提供了新思路。
中国科学院分子细胞科学卓越创新中心白梅竹博士、安徽医科大学第一附属医院国家卫健委配子与生殖道异常研究重点实验室梁丹教授和华东师范大学科学学院程艳博士为本论文的共同第一作者,吴宇轩教授为该论文的通讯作者。中国科学院分子细胞科学卓越创新中心李劲松院士给予了该项工作大力支持。
原文链接:https://link.springer.com/article/10.1007/s13238-022-00910-w


