

龙建纲/刘健康/张令强合作报道前列腺特异性癌基因OTUD6A促进前列腺癌发生机制
日期:2022-03-07 浏览次数:3121
前列腺癌是男性特有疾病,高居全球男性癌症发病率第二名。我国的前列腺癌发病率低于西方国家,但近年来呈现快速上升的态势。更严重得是,在我国,前列腺癌确诊时多处于发病晚期,特别是医疗不够发达的西部地区,患者确诊时处于晚期的占到60-70%,有效的早期诊断和治疗技术是防治前列腺癌的关键环节。
针对这一问题,2022年2月25日,西安交通大学龙建纲、刘健康课题组与军事医学科学院张令强课题组合作于Cell Death & Differentiation杂志发表了题为Prostate-specific Oncogene OTUD6A Promotes Prostatic Tumorigenesis via Deubiquitinating and Stabilizing c-Myc的研究论文。这项工作首次在人前列腺癌组织、前列腺癌细胞和转基因前列腺癌小鼠中证实,抑制OTUD6A可以通过重编程前列腺癌中MYC驱动的代谢重塑,实现抑制前列腺肿瘤的效果。
这项研究首次发现去泛素化酶家族成员OTUD6A是前列腺癌中特异性扩增的原癌基因,是前列腺中特有的c-Myc去泛素化酶,其高表达是促进前列腺癌发生的重要原因。c-Myc是一种不稳定的蛋白质,通过E3连接酶介导快速泛素化和降解。在80-90%的原发性前列腺癌患者中检测到c-Myc的mRNA和蛋白的过度表达。与前列腺癌另两个经典分子PTEN和p53的缺失/失活相比, c-Myc的激活发生得更早, 即在前列腺早期上皮内增生阶段。
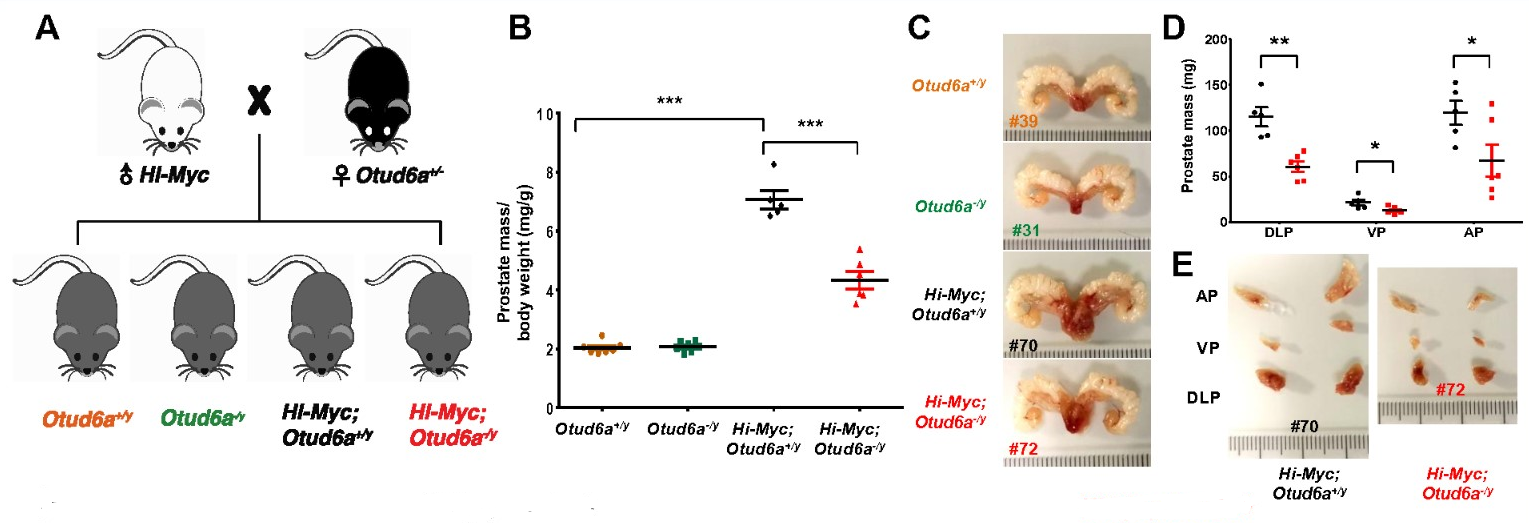
图1. Otud6a基因敲除小鼠与Hi-Myc转基因小鼠杂显著抑制Myc驱动的前列腺肿瘤发生
研究首先证实人前列腺癌样本中c-Myc的高表达维持在翻译后水平,确定OTUD6A是前列腺癌中c-Myc的生理性去泛素化酶,其蛋白水平与c-Myc丰度呈正相关,在体外和异种移植小鼠中,OTUD6A敲除能够抑制前列腺肿瘤的发生,同时Otud6a基因敲除小鼠与Hi-Myc转基因小鼠杂交后,显著抑制了Myc驱动的前列腺肿瘤发生(图1)。这项研究揭示OTUD6A可能是前列腺癌早期诊断和治疗中的关键靶分子(图2)。
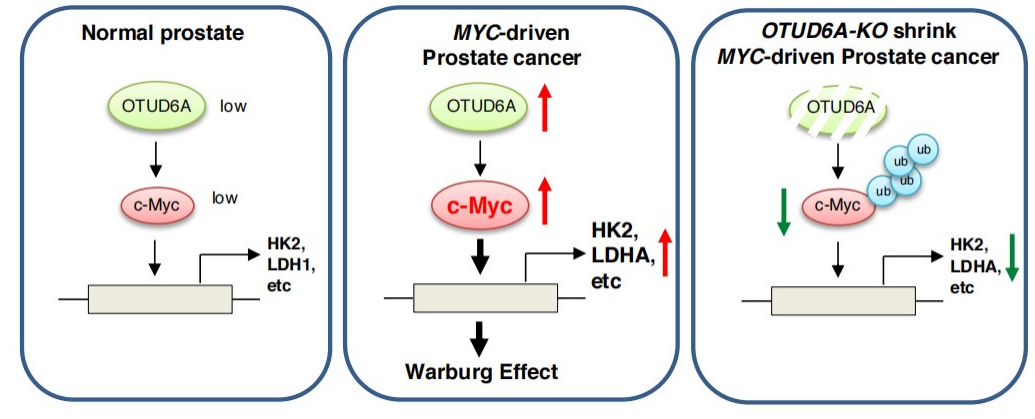
图2. OTUD6A可能通过去泛素化c-Myc重编程肿瘤代谢,提供有效的抗癌治疗
西安交通大学龙建纲教授、刘健康教授和军事医学科学院张令强教授为本论文的共同通讯作者。西安交通大学青年教师彭韵桦副教授、哈佛医学院刘静博士、西安交大博士研究生王珍、军事医学科学院崔春萍研究员为共同第一作者,参与这项工作的还包括哈佛医学院魏文毅教授、西安交大刘华东教授和温玉荣教授、中山大学郭剑平教授、武汉大学张金方教授、西安交大生命学院研究生张田田、张爽曦、高佩佩、侯占武。
该工作得到了国家自然科学基金、国家重点研发计划和中国博士后基金等项目的资助。这项成果是2021年该团队在基于能量代谢重编程进行癌症防治研究在Cell Research发表了“Skp2 dictates cell cycle-dependent metabolic oscillation between glycolysis and TCA cycle”论文后,又一突破性发现,为前列腺癌的预防和治疗带来了希望。
论文链接: https://www.nature.com/articles/s41418-022-00960-x