

PNAS:鲁伯埙/费义艳/丁澦团队发现变异亨廷顿蛋白结合化合物对亨廷顿病的潜在作用
日期:2022-03-04 浏览次数:1764
来源:BioArt
多种疾病由特定的致病蛋白质积累引起,而很多致病靶点蛋白功能很难被直接抑制,传统认为这些靶点“不可成药”。例如引起神经退行性疾病,亨廷顿舞蹈症的致病蛋白变异HTT(mHTT)就是备受关注的“不可成药”靶点。如何通过小分子化合物特异性靶向这些“不可成药”靶点是生物医药领域当前最重大的问题之一,具有重要的科学及临床价值。近年来的靶向“不可成药”靶点的思路集中在设计或发现双功能降解剂,例如PROTAC、ATTEC、LYTAC等靶向降解技术。这些技术已成功降解多个“不可成药”靶点,但依赖于发现同时结合靶点与细胞内降解机器的组装化合物或小分子胶水。前者往往分子很大、成药性存在局限,而后者则往往发现困难,缺乏系统性筛选的方法。另一类靶向此类靶点的策略是寻找“别构抑制剂”,但此类研究也往往要求靶点具有明确生化功能以及结构信息。
2022年3月1日,复旦大学生命科学学院鲁伯埙与丁澦课题组与信息科学与工程学院费义艳课题组合作在PNAS上发表Suppression of toxicity of the mutant huntingtin protein by its interacting compound, desonide的研究论文,提出可能可以通过筛选靶蛋白结合化合物并针对这些化合物进行表型筛选以发现“不可成药靶点”的“广义抑制剂”干预疾病,为疾病新药研发提供了可能的新策略。
经典的抑制剂通过直接结合靶蛋白的“活性口袋”改变其生化活性,而“广义抑制剂”则直接结合靶蛋白的某个区域而改变其最终对疾病表型的贡献,因此绕过了对靶蛋白“活性口袋”以及“生化活性”的要求。
在本次发表于PNAS的研究中,研究团队通过基于小分子芯片(Small Molecule Microarray, SMM)和无标记斜入射光反射差(Oblique-Incidence Reflectivity Difference, OI-RD)技术的新型高通量药物筛选平台发现了21种潜在的亨廷顿病致病蛋白mHTT的选择性结合剂,之后通过二级表型筛选测试了这些化合物对mHTT诱导的毒性的影响,并获得了四种可能拯救亨廷顿病相关表型的潜在mHTT结合化合物。其中,地奈德能很好地在亨廷顿病相关细胞和动物模型中抑制mHTT导致的毒性。进一步机理研究发现,地奈德通过结合mHTT的N端区域,增强mHTT在K6位点的多泛素化,使其更多靶向泛素-蛋白酶体途径降解。
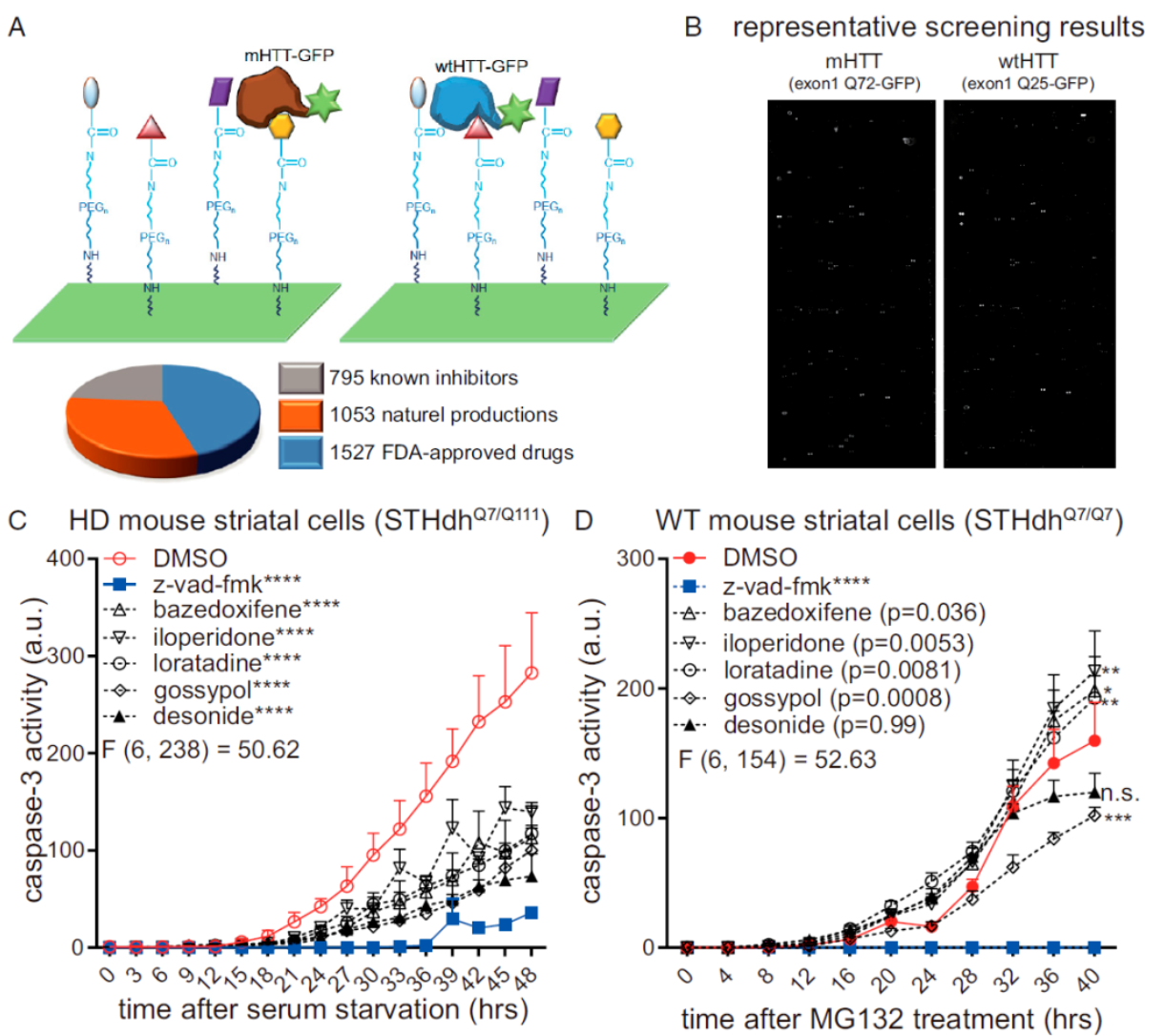
图A.高通量化合物芯片筛选示意图;B.典型筛选结果;C/D.部分mHTT结合化合物可拯救mHTT导致的细胞毒性
本研究为针对“不可成药”靶蛋白大规模药物筛选提供了一种新的模式:首先筛选致病靶蛋白的直接结合化合物,之后对相关化合物进行表型筛选,并通过相应的表型和机制研究明确作用机理。本研究为高效低成本筛选针对“不可成药”靶点靶向药物提供了一条可能的原创路径,而所发现的地奈德则可能在进一步优化开发后,成为干预或治疗亨廷顿病潜在药物。
复旦大学宋海坤、王岑和朱成钢博士为本文第一作者,王紫英、杨惠雅、吴鹏、崔笑添、贝勒医学院的Juan Botas教授和复旦大学党永军教授(现重庆医科大学)也参与了本项研究,鲁伯埙、费义艳和丁澦为该论文的通讯作者。
论文链接:https://www.pnas.org/doi/epdf/10.1073/pnas.2114303119