

Protein & Cell :张华凤/荚卫东/高平合作发现DOCK1调控二甲双胍治疗肝癌作用的新机制
日期:2022-03-01 浏览次数:2904
来源:BioArt
二甲双胍作为最常用的降糖药物,已经被报道在多种肿瘤中可作为潜在的抗肿瘤药物【1,2】。然而,由于二甲双胍的具体作用靶点不明确,极大地限制了我们对二甲双胍的理解和应用,并且二甲双胍在不同亚型的肿瘤中疗效并不相同【3-5】。
2022年2月26日,中国科学技术大学张华凤研究组、华南理工大学高平研究组与中科大附一院荚卫东研究组合作在Protein & Cell杂志在线发表了题为Genome-wide CRISPR screen identifies synthetic lethality between DOCK1 inhibition and metformin in liver cancer 的论文,报道了肝癌中DOCK1可以调控二甲双胍的抗肿瘤活性,为二甲双胍在肝癌中的精准应用提供了理论依据。
为了探究哪一种亚型的肝癌患者适用于二甲双胍治疗,作者采用CRISPR-Cas9文库筛选的策略(图1),鉴定出DOCK1的缺失能够增强肝癌细胞对二甲双胍的敏感性,并在细胞、类器官、小鼠原位肝癌等多种模型中验证了抑制DOCK1能够增强二甲双胍对肝癌细胞的杀伤作用。进一步的机制研究表明,二甲双胍通过促进DOCK1酪氨酸位点发生磷酸化,活化RAC1信号通路,促进肝癌的存活,导致肝癌细胞对二甲双胍产生耐受。而使用DOCK1的抑制剂TBOPP,可以协同增强二甲双胍的抗肿瘤作用,在体内体外多种模型中显示更强的抗肿瘤效果。
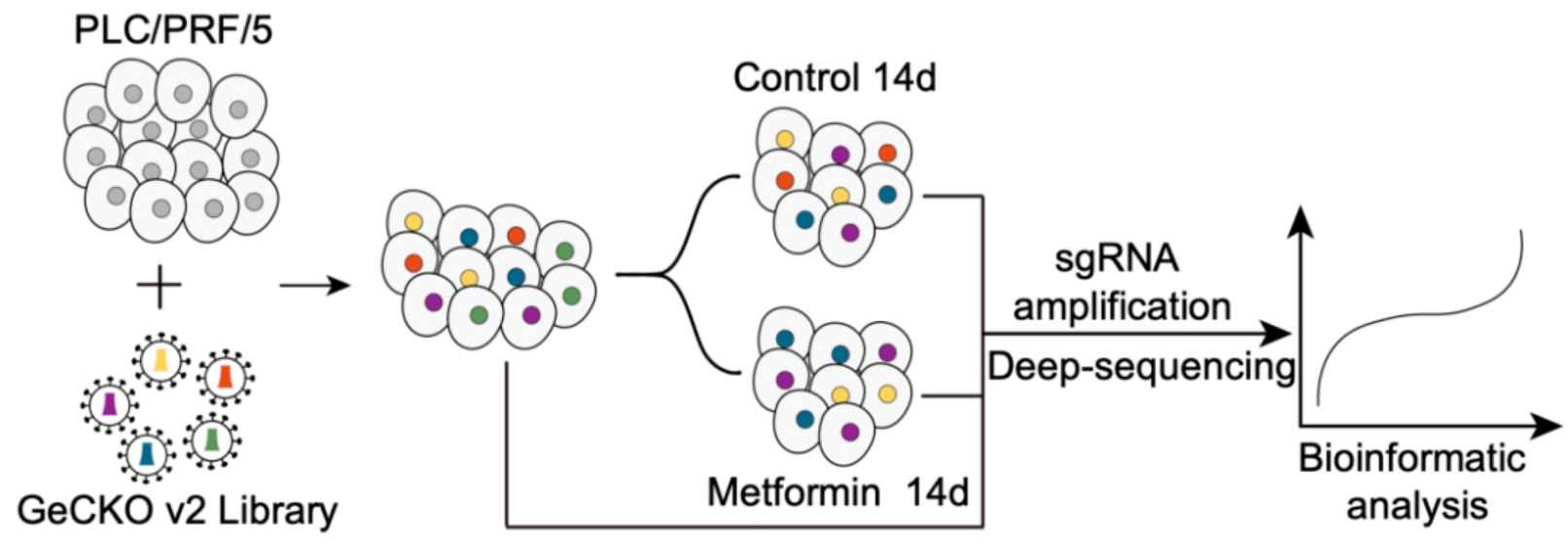
图 1. CRISPR-Cas9文库筛选策略
为了探究DOCK1是否可以作为评估二甲双胍对肝癌患者治疗效果的生物标志物,作者对122例患有糖尿病的肝癌患者进行了回顾性研究。有趣的是,在患有糖尿病的肝癌患者中,二甲双胍选择性地延长了低表达DOCK1的肝癌患者的总体生存期,而在高表达DOCK1的肝癌患者中,使用二甲双胍处理反而呈现较差的预后趋势,提示DOCK1的表达水平可以预测二甲双胍在肝癌中的抗肿瘤效果。
进一步,通过对临床样本中DOCK1表达水平的分析,作者发现,与癌旁组织或正常组织相比,DOCK1在肝癌中的表达显著升高。值得注意的是,DOCK1的表达在肝癌患者中具有高度异质性,部分患者肿瘤组织中DOCK1表达水平很高,但也有部分患者肿瘤组织中DOCK1表达水平极低,甚至检测不到。DOCK1在肝癌中表达的高度异质性可能是导致二甲双胍治疗肝癌患者疗效显著差异的原因之一。本研究提示临床上可以根据患者肿瘤组织中DOCK1的表达水平决定是否使用二甲双胍进行治疗。
令人兴奋的是,厦门大学林圣彩教授团队及其合作者近日发表在Nature杂志上的研究,突破性地发现低浓度的二甲双胍可以与PEN2分子直接结合,通过PEN2-ATP6AP1轴激活AMPK【6】。林圣彩团队的工作首次鉴定了二甲双胍发挥功能的直接作用靶点并阐明了其具体分子机制,为二甲双胍的应用提供了新的思路【6】。而本项研究则表明DOCK1的表达水平可以调控二甲双胍在肝癌中的抗肿瘤活性,并提出DOCK1Low的肝癌患者适用于二甲双胍治疗,而DOCK1High的肝癌患者单独使用二甲双胍治疗效果不好,联合靶向DOCK1可以增强二甲双胍在这类患者中的抗肿瘤作用(图3)。该研究有助于推动二甲双胍在抗肝癌治疗中的合理应用,为肝癌患者的精准治疗提供了新的思路。

图3. DOCK的表达水平决定二甲双胍在肝癌中的抗肿瘤效果
中国科学技术大学的博士研究生冯君茹和陆慧为论文的共同第一作者,张华凤教授、高平教授和荚卫东教授为论文的共同通讯作者。研究工作得到了中国科学技术大学瞿昆教授以及安徽医科大学蔡永萍副教授的大力支持。
原文链接:https://doi.org/10.1007/s13238-022-00906-6
参考文献:
1. PERNICOVA I, KORBONITS M. Metformin--mode of action and clinical implications for diabetes and cancer [J]. Nat Rev Endocrinol, 2014, 10(3): 143-56.
2. POLLAK M N. Investigating metformin for cancer prevention and treatment: the end of the beginning [J]. Cancer Discov, 2012, 2(9): 778-90.
3. LORD S R, CHENG W-C, LIU D, et al. Integrated Pharmacodynamic Analysis Identifies Two Metabolic Adaption Pathways to Metformin in Breast Cancer [J]. Cell metabolism, 2018, 28(5).
4. LEE J, YESILKANAL A E, WYNNE J P, et al. Effective breast cancer combination therapy targeting BACH1 and mitochondrial metabolism [J]. Nature, 2019, 568(7751): 254-8.
5. XIE J, XIA L, XIANG W, et al. Metformin selectively inhibits metastatic colorectal cancer with the KRAS mutation by intracellular accumulation through silencing MATE1 [J]. Proc Natl Acad Sci U S A, 2020, 117(23): 13012-22.
6. MA T, TIAN X, ZHANG B, et al. Low-dose metformin targets the lysosomal AMPK pathway through PEN2 [J]. Nature, 2022.