

Nat Commun | 甘振继教授发表骨骼肌含量调控的新机制
日期:2022-02-18 浏览次数:4085
来源:BioArt
骨骼肌作为人体最大的器官(约占人体重的40%),不但是人类精彩生命运动的基础,还是机体至关重要的能量代谢器官,更是健康体魄的根本保证。骨骼肌具有高度的可塑性,骨骼肌含量随着运动负荷、衰老与疾病状态等因素的变化而改变。肌肉废用如不运动、疾病或衰老可引发肌肉萎缩,导致肌肉进一步衰减恶性循环,从而降低人的生活质量,增加死亡风险。肌肉衰减已经成为当前亟待解决的健康医学问题。
2022年2月16日,南京大学医学院模式动物研究所甘振继教授课题组在Nature Communications上在线发表了题为 Disuse-associated loss of the protease LONP1 in muscle impairs mitochondrial function and causes reduced skeletal muscle mass and strength 的研究成果。此项工作揭示了肌肉废用过程中线粒体蛋白质量控制与肌肉含量和功能维持之间的机制关联。
骨骼肌富含线粒体,线粒体对骨骼肌的功能至关重要。因此,骨骼肌线粒体需要精细的、多层次的质量监控系统来保障其功能。线粒体蛋白酶被认为是线粒体质量控制的第一道防线。尽管越来越多的研究提示其在线粒体功能保障中的作用非常关键,但线粒体蛋白质稳态控制对于生理及病理应激的响应及其功能还不甚清楚。
作者在人和小鼠肌肉萎缩样本中,对多层次的线粒体质量监控机器进行了系统的考察。研究发现骨骼肌线粒体蛋白酶LONP1特异性的响应肌肉废用信号,在人和小鼠中均与肌肉废用引发的肌肉萎缩密切相关。作者利用多个LONP1缺失的小鼠模型以及体外原代肌肉细胞培养系统展开了详细研究,发现LONP1依赖的线粒体蛋白质稳态控制对肌肉含量和功能维持至关重要。LONP1的缺失会引起线粒体形态异常,功能损伤,蛋白周转减缓,激活自噬-溶酶体降解程序,这导致了肌肉含量减少,力量降低。进一步的机制研究发现,线粒体蛋白酶LONP1的缺失导致其特异性调节底物PARK7蛋白的异常积累,引发肌细胞过度的自噬。
此外,为了进一步确证线粒体蛋白质稳态控制与肌肉含量之间的机制关联,作者还构建了另一种转基因小鼠模型,在肌肉中特异性过表达一种线粒体驻留的错误折叠蛋白——突变形式的鸟氨酸转氨甲酰酶 (ΔOTC)。该转基因小鼠也展现出与LONP1肌肉缺失小鼠类似的表型。而通过在该小鼠的肌肉中过表达LONP1蛋白酶可恢复线粒体蛋白质稳态、线粒体功能与肌肉含量。
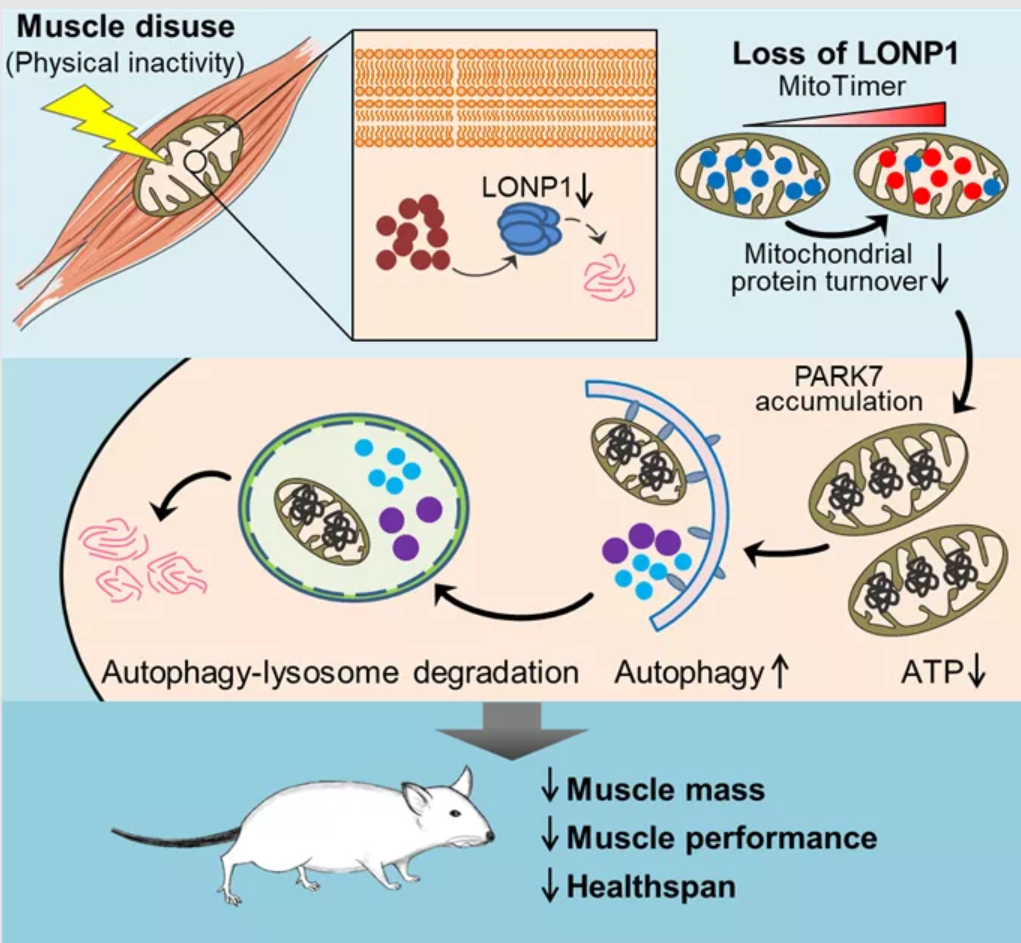
线粒体蛋白稳态控制感应肌肉废用介导肌肉萎缩
这项研究表明线粒体蛋白酶LONP1是肌肉废用引起的肌肉萎缩的感应器和调节器,揭示了骨骼肌含量调控的新机制,并提出了“线粒体蛋白质量控制决定肌肉含量”的新概念。研究工作为探寻防治肌肉萎缩的新途径提供了实验依据。
南京大学博士研究生徐志圣,付婷婷和郭奇奇为本文的共同第一作者,南京大学的甘振继教授为该篇论文的通讯作者。该研究得到合作实验室的大力协助与支持。
原文链接:https://www.nature.com/articles/s41467-022-28557-5.pdf