

北京大学高宁团队给出了学界广泛认可的脂筏中的膜微结构域的组织和功能化的一般模型
日期:2022-01-05 浏览次数:7944
来源:iNature
膜成分横向分离成功能性微区,概念上称为脂筏,是原核生物和真核生物细胞膜的通用组织原则。广泛存在的 Stomatin、Prohibitin、Flotillin 和 HflK/C (SPFH) 家族蛋白在不同亚细胞位置的功能性膜微域中富集,因此被假设为在微域形成中发挥支架作用。此外,许多 SPFH 蛋白也与膜上发生的高度特异性过程有关。然而,这些功能都没有在分子水平上被理解。
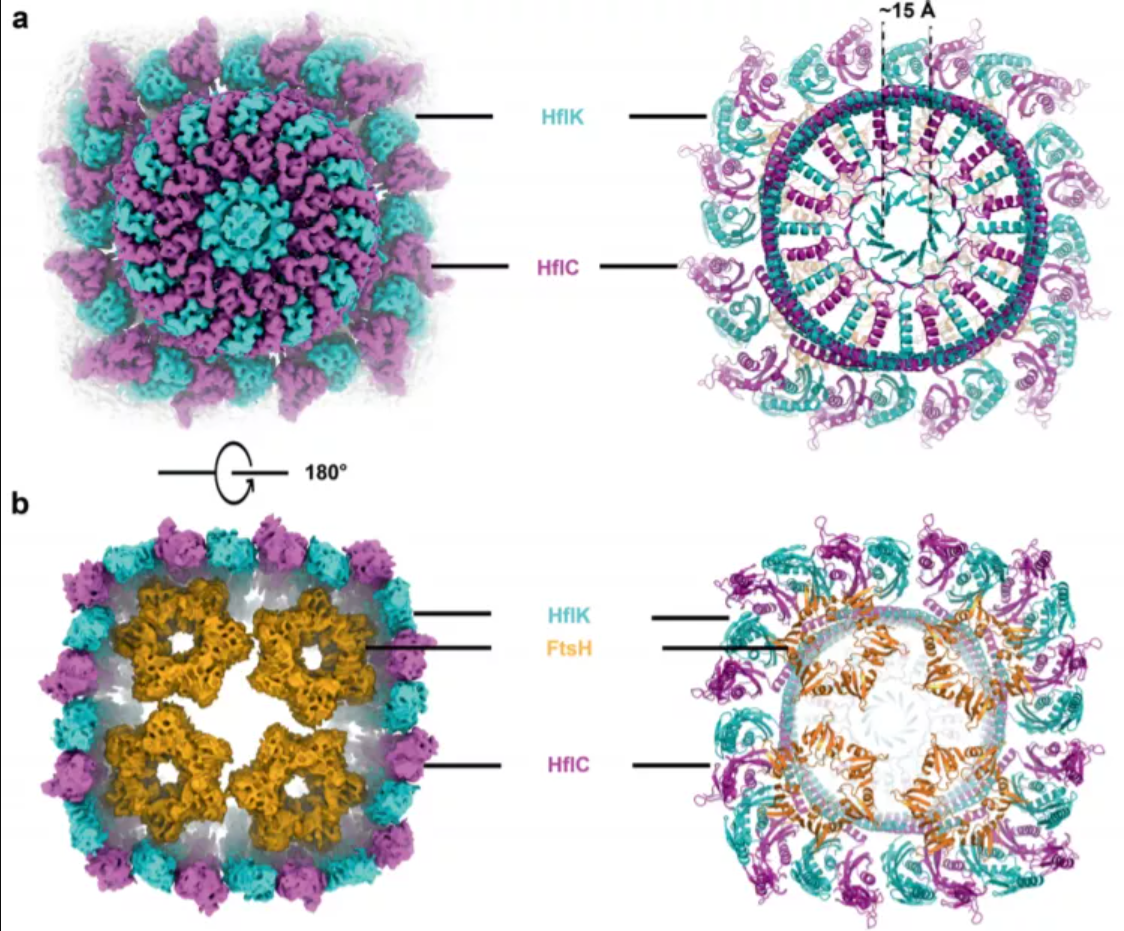
HflK 和 HflC 形成一个圆形的 24 聚体组件,具有横向隔离的膜微区(直径 20 nm),与 HflK/C 的跨膜结构域和完全密封的周质穹窿接壤。四个 FtsH 六聚体通过与拱顶内表面的相互作用嵌入到这个微域中。这些观察结果为 HflK/C 及其线粒体同系物抑制素在调节膜结合 AAA+ 蛋白酶中的作用提供了机械解释,并提出了 SPFH 蛋白对膜微结构域的组织和功能化的一般模型。
细胞膜的组成极其异质,脂质和蛋白质的分布非随机。来自所有三个生命王国的细胞膜的一个普遍特征是存在横向隔离的纳米级微区,作为细胞许多基本功能的分隔平台。这些功能性膜微结构域 (FMM) 的组织和调节最适合于真核细胞质膜,“脂筏”作为一种广为接受的模型,用于描述这些相对有序的离散微结构,这些微结构是通过富集胆固醇,鞘脂和某种类型的蛋白质之间的相互作用形成的。虽然细菌通常不含甾醇脂质,但它们的膜类似地组织成微结构域 ,这些微结构域也需要 FMM 特定的脂质种类。
作为标记蛋白,SPFH(Stomatin、Prohibitin 、Flotillin 和 HflK/C) 家族蛋白富含各种亚细胞定位的原核和真核 FMM,包括质膜、细胞核、高尔基体、内质网 (ER)、内体、脂滴和线粒体。SPFH 蛋白在自寡聚化成大型跨膜或膜锚定复合物方面的共同特性表明它们在 FMM 的形成和组织中具有潜在的支架作用。
除了这种一般功能之外,由于它们能够与不同的蛋白质伙伴相互作用,SPFH 家族成员在高度多样化的细胞过程中具有非常特殊的调节作用。例如,哺乳动物 flotillins 存在于质膜、内体和外泌体中,并调节各种信号转导和膜运输事件。同样,细菌 flotillins 也很丰富,并与 FMM 中的各种货物蛋白共定位。SPFH 家族蛋白的一些成员显示出高度专业化的功能:秀丽隐杆线虫 stomatin MEC-2 及其小鼠同源物 stomatin 样蛋白 3 (SLP3) 通过将酸感应离子通道连接到细胞骨架而参与机械感觉,而人类 erlins与 ER 相关降解 (ERAD) 途径的组分和泛素连接酶 RNF170 相互作用以介导肌醇三磷酸受体的降解(IP3R)。
完整KCF复合体的整体结构(图源自Cell Research )
与这些细胞 SPFH 蛋白不同,抑制素 (prohibitins,PHB1/2) 主要存在于线粒体的内膜中。PHB1 首先被确定为潜在的肿瘤抑制因子,从那时起,抑制素已被证明对线粒体的动力学,代谢以及细胞存活和增殖各个方面都很重要。靶向抑制素的小分子也显示出对癌症和神经退行性、代谢性和炎症性疾病的有希望的作用。PHB1/2 及其细菌同源物 HflK/C 通过分别与六聚体 AAA+ 膜结合蛋白酶 Yta10/Yta12 和 FtsH 直接相互作用,在调节膜蛋白质量控制和体内平衡方面具有共同的功能。因此,抑制素对生理学和病理学的许多多效作用可以通过线粒体 AAA+ 蛋白酶的不同底物来解释。

KCF复合体在膜蛋白质量控制中的模型和SPFH家族蛋白组织FMM的结构基础(图源自Cell Research )
然而,SPFH 家族蛋白的作用,无论是在一般 FMM 支架中还是在专门的调节功能中,都没有在分子水平上被理解。先前对不同 SPFH 成员片段的结构研究,包括小鼠 stomatin、Pyrococcus horikoshii stomatin和溶藻弧菌 FliL以及人类 PHB的卷曲螺旋区域,提供了截然不同的亚基间排列。重要的是,低分辨率电子显微镜数据揭示了来自酿酒酵母的 PHB1/2 复合物和蓝细菌 stomatin 同系物的环形空心组件。 抑制素复合物中 PHB1/2 异源二聚体的拷贝数估计为 12 到 16,而 HflK/C 的拷贝数为 6 到 10。因此,跨膜 SPFH 复合物的确切组成和亚基排列,以及它们与其他蛋白质的潜在相互作用,在很大程度上仍不清楚
在目前的工作中,大肠杆菌 HflK 和 HflC 被用作 SPFH 家族蛋白质结构表征的模型系统。类似于线粒体抑制素,HflK 和 HflC 与膜结合的 FtsH 复合物共同纯化并调节其对细胞质和膜底物的蛋白水解活性。因此,该研究制备了由 HflK、HflC 和 FtsH 形成的复合物,并使用冷冻电子显微镜 (cryo-EM) 获得该膜超组装的高分辨率结构。2.7 MDa 结构显示了一个巨大的结构,与 12 个 HflK-HflC 二聚体拷贝相邻,以提供一个大的、分隔的周质笼和一个横向隔离但细胞质暴露的膜区域,其中包含四个嵌入的 FtsH 六聚体。这些特征为 FMM 组织提供了一个简单的模型,即 SPFH 蛋白寡聚化为纳米级圆形组件,以促进脂质和膜蛋白的分隔。
参考消息:https://www.nature.com/articles/s41422-021-00598-3