

陈玲玲团队发现体外合成环形RNA的免疫原性机制和潜在应用
日期:2021-12-24 浏览次数:5591
来源:BioArt
大多数环形RNA来自外显子反向剪接,以共价键形成闭环结构。研究发现这类分子具有独特的生成加工过程,不同于线性RNA的折叠构象,并具有高稳定性。这些特色使得环形RNA在基因表达调控中具有重要功能,包括参与信号转导、细胞增殖、天然免疫调控等【1】,并且具有独特的应用潜能,如环形RNA通过双链区域能够抑制PKR的异常磷酸化【2】,可以作为翻译载体用于功能性蛋白质的表达【3,4】等。
需要指出的是,研究体外合成环形RNA的潜在应用需关注两个重要问题,一是如何提高体外合成环形RNA的效率,二是合成的环形RNA是否具有免疫原性。一方面,近期研究报道指出体外合成的环形RNA能够被天然免疫受体RIG-I所识别,进而引起细胞内天然免疫反应【5,6】;而另一方面,也有研究者认为体外合成的环形RNA无免疫原性【4】,并指出细胞内免疫反应是由于环形RNA中存在微量线性RNA的污染导致。
2021年12月23日, 中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)陈玲玲研究组在Molecular Cell上发表了文章RNA circles with minimized immunogenicity as potent PKR inhibitors。通过对不同方式体外合成环形RNA的特性深入比较分析,该研究阐明了体外合成环形RNA免疫原性的问题及分子机制,并发现无免疫原性且具有双链结构的环形RNA能够高效抑制天然免疫因子PKR的激活,揭示体外合成环形RNA用于治疗PKR异常激活相关自身免疫疾病的应用潜能。该工作为进一步研究环形RNA在天然免疫中的功能及机制奠定基础,并为利用环形RNA进行炎症性自身免疫病的干预治疗提供了新途径。
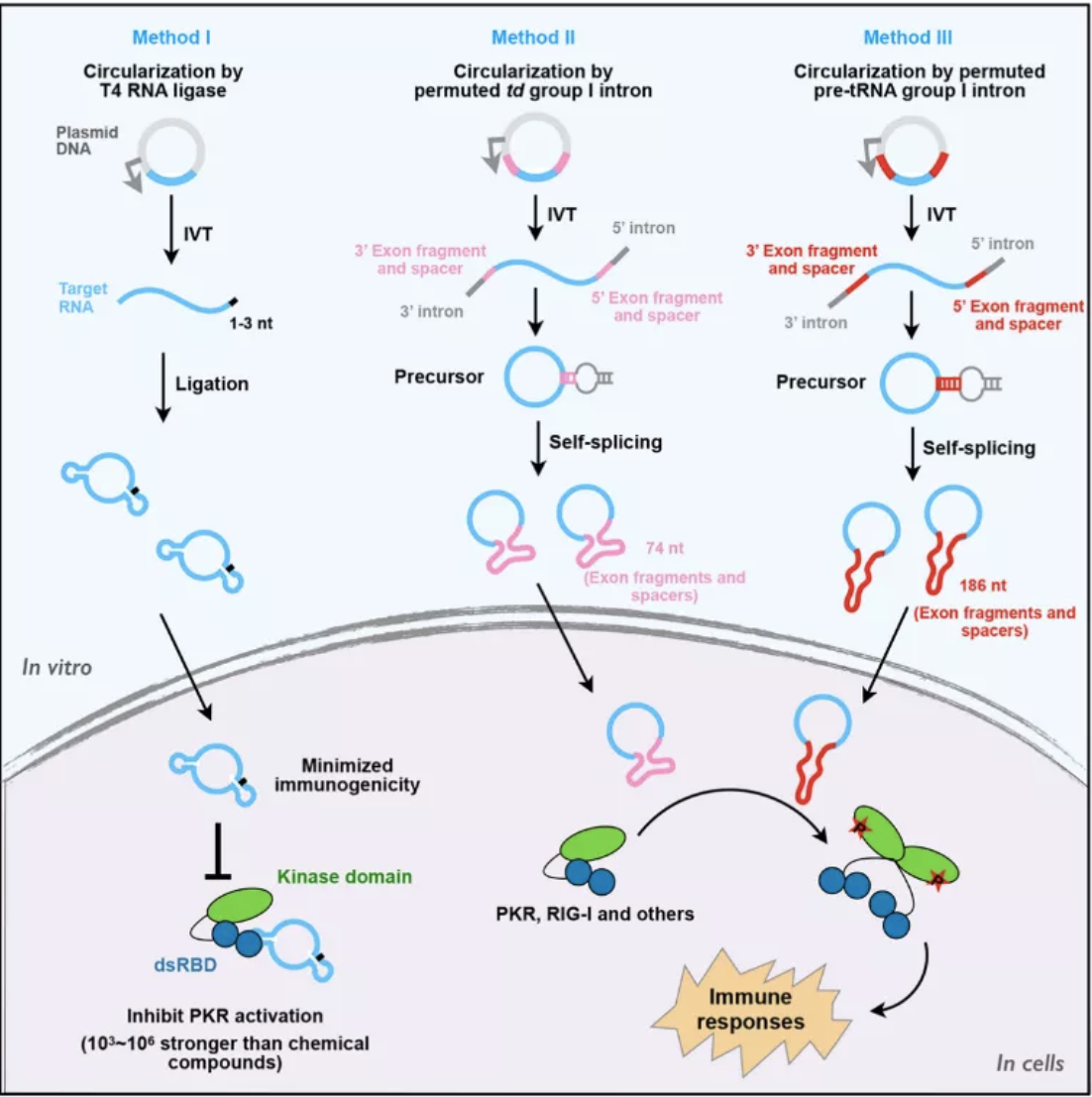
为阐明上述重要问题,陈玲玲团队首先比较了不同方式体外合成环形RNA的效率及免疫原性。目前已知体外合成环形RNA主要有两种途径:基于T4 RNA连接酶的催化直接分子内连接成环,以及基于I型内含子核酶进行自剪接成环。实验结果表明,T4 RNA连接酶合成的环形RNA,包括可作为核酸适配体的环形RNA和可翻译的环形RNA,均不会引起细胞内天然免疫反应,然而通过两种不同I型内含子T4 bacteriophage和Anabeana自剪接形成的环形RNA均能够引起细胞内天然免疫反应。
进一步对不同环化方式合成的环形RNA进行序列和二级结构的比较分析发现,基于T4 RNA连接酶合成的环形RNA,仅引入1到3个外源核苷酸,然而两种I型内含子体外自剪接形成的环形RNA会分别引入74个或186个外源核苷酸。科研人员利用改进的circSHAPE-MaP技术【2】进一步解析了不同途径合成的环形RNA二级结构,发现这些外源序列的引入会改变目的环形RNA的折叠构象,如与环形RNA内部序列配对,或外源序列自身形成了稳定的双链结构。这些结果说明,I型内含子自剪接成环引入的外源序列可能是导致体外合成环形RNA引起细胞内天然免疫反应的原因。
陈玲玲研究组前期工作发现,在系统性红斑狼疮 (SLE) 病人来源的PBMC或T细胞中过表达含有16-26bp短的双链结构的内源环形RNA可抑制PKR及疾病标志基因的异常激活【2】,提示体外合成无免疫源性且含有短的双链结构的环形RNA有望成为治疗自身免疫疾病的全新手段。目前已报道的抑制PKR异常磷酸化激活的小分子化合物,如 2-Aminopurine (2-AP),oxindole/imidazole derivative compound 16 (C16) 等,均存在一定的局限性。例如,2‐AP存在其它激酶的非特性抑制,而C16 会被体内快速代谢清除且影响细胞正常增殖。研究人员发现通过T4 RNA连接酶合成的环形RNA,不仅免疫原性低,且保留了和体内相似的16-26bp短的双链结构。进一步实验证明,这类体外合成的环形RNA仍然能够在体外及细胞内抑制PKR的激活,并且相对于小分子抑制剂具有约千倍以上更好的抑制效果。
综上,该研究为进一步应用体外合成的环形RNA奠定了重要基础,也为进一步研发基于环形RNA技术的核酸适配体和基因治疗领域带来可期前景。
附图. 体外合成环形RNA的免疫原性机制和潜在应用
中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)陈玲玲研究组博士后刘楚霄博士和博士研究生郭思坤为该论文的共同第一作者,陈玲玲研究员为该论文的通讯作者。这项工作得到了中国科学院上海营养与健康研究院杨力研究员,陈玲玲组博士研究生徐奕锋和杨力组南芳博士的大力支持。
原文链接:https://doi.org/10.1016/j.molcel.2021.11.019
1. Chen, L.L. (2020). The expanding regulatory mechanisms and cellular functions of circular RNAs. Nat Rev Mol Cell Biol 21, 475-490.
2. Liu, C.X., Li, X., Nan, F., Jiang, S., Gao, X., Guo, S.K., Xue, W., Cui, Y., Dong, K., Ding, H., et al. (2019). Structure and Degradation of Circular RNAs Regulate PKR Activation in Innate Immunity.
3. Wesselhoeft, R.A., Kowalski, P.S., and Anderson, D.G. (2018). Engineering circular RNA for potent and stable translation in eukaryotic cells. Nat Commun 9, 2629.
4. Wesselhoeft, R.A., Kowalski, P.S., Parker-Hale, F.C., Huang, Y., Bisaria, N., and Anderson, D.G. (2019). RNA Circularization Diminishes Immunogenicity and Can Extend Translation Duration In Vivo. Mol Cell 74, 508-520 e504.
5. Chen, Y.G., Kim, M.V., Chen, X., Batista, P.J., Aoyama, S., Wilusz, J.E., Iwasaki, A., and Chang, H.Y. (2017). Sensing Self and Foreign Circular RNAs by Intron Identity. Mol Cell 67, 228-238 e225.
Cell 177, 865-880 e821.
6. Chen, Y.G., Chen, R., Ahmad, S., Verma, R., Kasturi, S.P., Amaya, L., Broughton, J.P., Kim, J., Cadena, C., Pulendran, B., et al. (2019). N6-Methyladenosine Modification Controls Circular RNA Immunity. Mol Cell 76, 96-109 e109.