

Protein & Cell | 人源类器官揭示肝母细胞瘤发生关键驱动因素及机制
日期:2021-12-16 浏览次数:4660
来源:BioArt
肝母细胞瘤是一种儿童肝脏恶性肿瘤。与肝癌、胆管癌等成人肝脏恶性肿瘤不同,肝母细胞瘤由肝前体细胞发展而来,其成因与乙型肝炎病毒感染和肝硬化无关。因缺乏人肝母细胞瘤发生模型,其发病机制研究尚不清晰,药物策略尚不明确。在肝母细胞瘤患者中,80%以上患者肿瘤样本显示Wnt-β-catenin和Hippo-YAP通路的过度激活【1】。研究表明,成年小鼠肝脏中共同表达激活型β-catenin和YAP1能够导致肝脏恶性肿瘤发生。但因该模型在小鼠分化成熟的肝实质细胞中建立,无法呈现肝母细胞瘤来源于肝前体细胞的基本事实【1】。
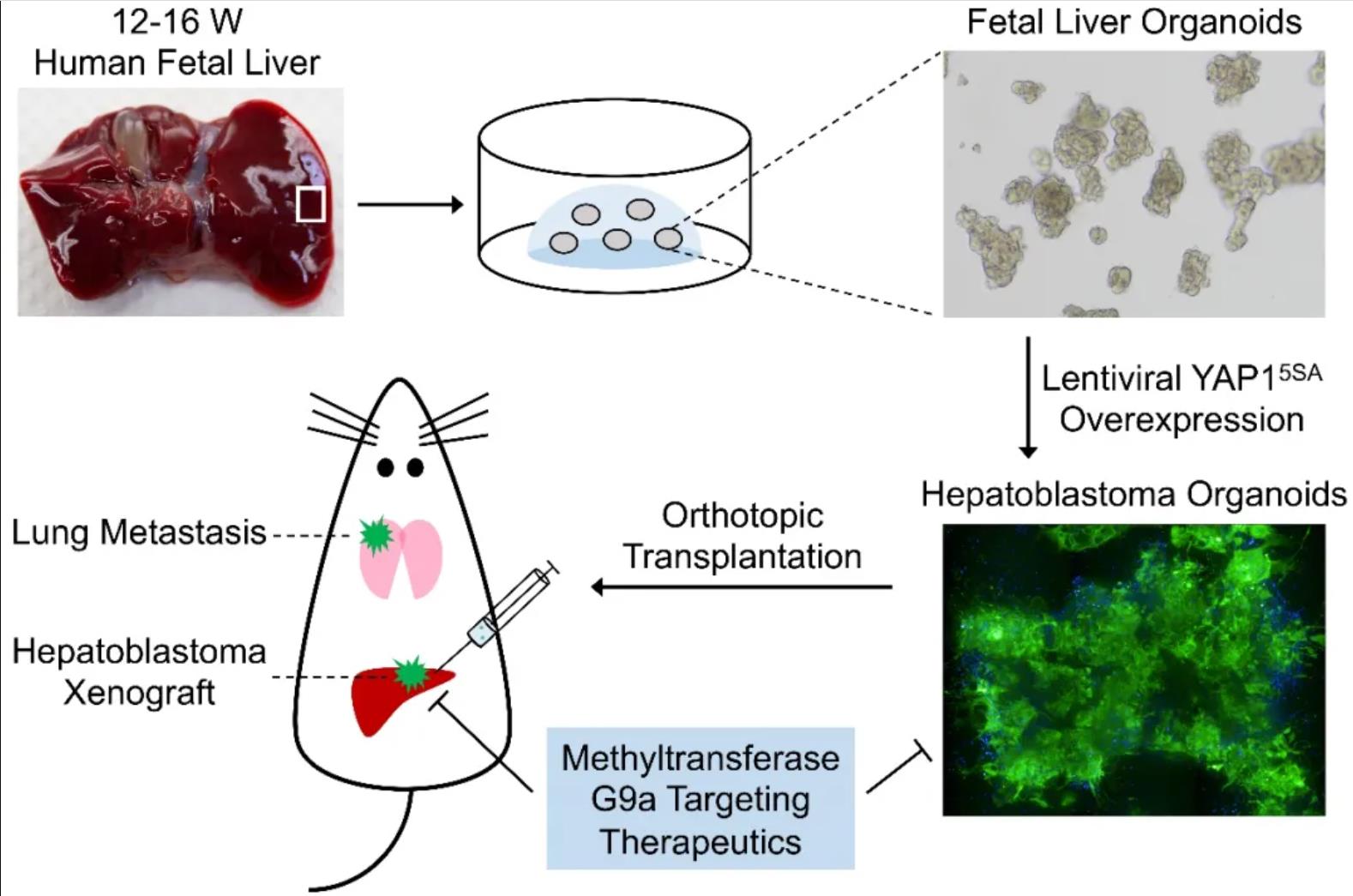
2021年12月10日,复旦大学赵冰、李晋合作在Protein & Cell上发表了题为Modeling hepatoblastoma development with human fetal liver organoids reveals YAP1 activation is sufficient for tumorigenesis 的研究论文。该研究首次建立人肝母细胞瘤发生模型,确定了Hippo-YAP激活是人肝母细胞瘤发生的关键驱动因素,厘清了领域认知,同时提示模型选择对疾病研究的重要性。利用该模型,研究者发现Hippo-YAP驱动人肝母细胞瘤发生与一碳循环紊乱相关,并发现组蛋白甲基转移酶G9a拮抗剂可干预肝母细胞瘤发生发展,为后续人肝母细胞瘤诊治提供重要基础。
研究者优化了人胚肝类器官培养策略【2】,使其维持肝前体细胞命运状态,再经病毒载体引入肝母细胞瘤潜在危险因素:β-catenin(β-cateninΔex3)和YAP1(YAP15SA)。研究者发现,Wnt-β-catenin和Hippo-YAP过度激活均能刺激人胚肝类器官活跃增殖,但仅YAP15SA可诱导恶性肿瘤的发生,其形成的人肝母细胞瘤类器官移植到NSG免疫缺陷小鼠肝包膜下,可生长为人肝母细胞瘤,并发生自发性的肺脏定向转移,高度模拟临床肝母细胞瘤行为特征。同时,β-catenin转录活性抑制剂对YAP15SA驱动肝母细胞瘤没有明显影响,表明Hippo-YAP激活是人肝母细胞瘤发生的关键驱动因素,提示模型选择对疾病发生机制研究的重要性。进一步代谢组学分析发现Hippo-YAP激活导致人胚肝类器官一碳代谢紊乱,揭示YAP1-G9a轴是肝母细胞瘤发生的分子机制,且G9a拮抗剂可有效干预肝母细胞瘤发生发展。
在模式动物的基础上,应用人胚胎来源组织建立类器官模型,直接研究人器官发育,将帮助我们深入认知人与模式动物器官发育的保守型和特殊性。同时,相比于复杂的动物模型,人源类器官模型具备可扩增、高通量和便于基因操纵的特点,能够开展更多的疾病发生机制研究和药物筛选。
复旦大学生命科学学院赵冰、李晋为本文共同通讯作者。复旦大学生命科学学院林鑫华教授、附属妇产科医院陈晓军主任为工作开展提供重要支持。本项工作依托复旦大学遗传工程国家重点实验室类器官研究中心开展,中心与复旦大学附属医院合作,建立了遗传背景清晰、稳定维持、可冻存复苏的多谱系、多癌种人源类器官种质资源库,覆盖正常组织、胚胎组织及进展肿瘤,为基于人源类器官的发育及疾病研究提供重要支撑。
原文链接:
https://doi.org/10.1007/s13238-021-00893-0