

刘兴国/裴端卿/陈可实团队发现激酶解锁异染色质的“递进修饰”模式
日期:2021-11-26 浏览次数:7462
来源:BioArt
细胞核中的染色质分为常染色质、异染色质。常染色质处于伸展状态,有转录活性,而异染色质处于聚缩状态,无转录活性,这两者的相互转换在细胞命运转变的关键。体细胞重编程为诱导多能干细胞(iPSC)的过程必然在染色质水平发生显著重塑,因此是研究表观遗传调控的理想模型。通过这一模型,发现了细胞质信号调控DNA甲基化【1】,组蛋白甲基化【2】,组蛋白乙酰化、乳酸化【3】等细胞核表观遗传的系列全新模式。然而,激酶介导的磷酸化信号,作为细胞应答外界的最重要信号,其在细胞核染色质蛋白修饰中的作用,是一个亟待回答的科学问题。
2021年11月24日,中科院广州生物医药与健康研究院刘兴国/裴端卿/陈可实团队在Cell Death & Differentiation杂志上发表了文章“MAP2K6 Remodels Chromatin and Facilitates Reprogramming by Activating Gatad2b-Phosphorylation Dependent Heterochromatin Loosening”(MAP2K6 通过激活 Gatad2b 磷酸化依赖性的异染色质松散来重塑染色质并促进重编程)【4】。该研究发现MAPK信号通路二级激酶MAP2K6,通过磷酸化Gatad2b来打开异染色质,并且提高多能性基因启动子区域的组蛋白乙酰化修饰,最终提高多能性基因的表达,促进多能性的获得。这一工作不仅揭示了MAP2K磷酸化介导的染色质状态在细胞命运调控中的作用,而且发现了激酶起始磷酸化-乙酰化的蛋白“递进修饰”的信号转导新模式。
MAPK信号通路是一个三级级联激酶系统,对细胞外界各种刺激有开关应答式的反应,它们参与并调控如细胞分化、凋亡、转化及衰老等多种细胞生理病理活动。MKK蛋白属于MAPK级联系统的中心激酶,它们有双重特征,既能被特异的上游激酶激活,又能激活特异的下游激酶,以保证信号传导的精确性。在MAP2K1-7等7个二级激酶中仅MAP2K3和MAP2K6两个激酶能解离异染色质并高效促进重编程。这两个激酶结构相似,功能相近,拥有共同的下级激酶P38,然而,尽管它们发挥异染色质解离功能依赖于激酶活性,但并不是通过激活P38。通过磷酸化蛋白组学,鉴定出MAP2K6的一个新的磷酸化靶蛋白Gatad2b。
Gatad2b是ATP依赖的染色质重塑复合物NuRD的重要组分之一,可参与核小体的重塑和组蛋白的乙酰化修饰。MAP2K6通过磷酸化Gatad2b的S487和T490位点来解离异染色质,并促进组蛋白乙酰化修饰。解离异染色质后,MAP2K6促进重编程因子Sox2和Klf4分别对它们下游靶标的结合和转录激活,进而促进多能性的获得。
在经典的激酶信号通路中,信号通过蛋白磷酸化传递;而在这项最新研究中,发现信号可由蛋白磷酸化递进传递到蛋白的乙酰化。研究人员发现二级激酶家族7个蛋白中MAP2K3/6可通过磷酸化Gatad2b进而调控组蛋白的乙酰化。这表明了不同的蛋白翻译后修饰存在着“递进修饰”的信号转导新模式,并在多能干细胞命运调控中发挥着重要功能。这正像“葫芦娃”七兄弟中的老三、老六,具有把磷酸化信号变为乙酰化信号的“递进修饰”特殊本领。
MAPK通路接受多种细胞外刺激,并在细胞分化、凋亡、转化及衰老等多种生命过程中发挥关键作用。该工作表明该通路通过组蛋白修饰来调节基因表达,阐明的这一细胞外刺激和细胞内基因表达之间的新信号通路具有广泛的生理和病理意义。
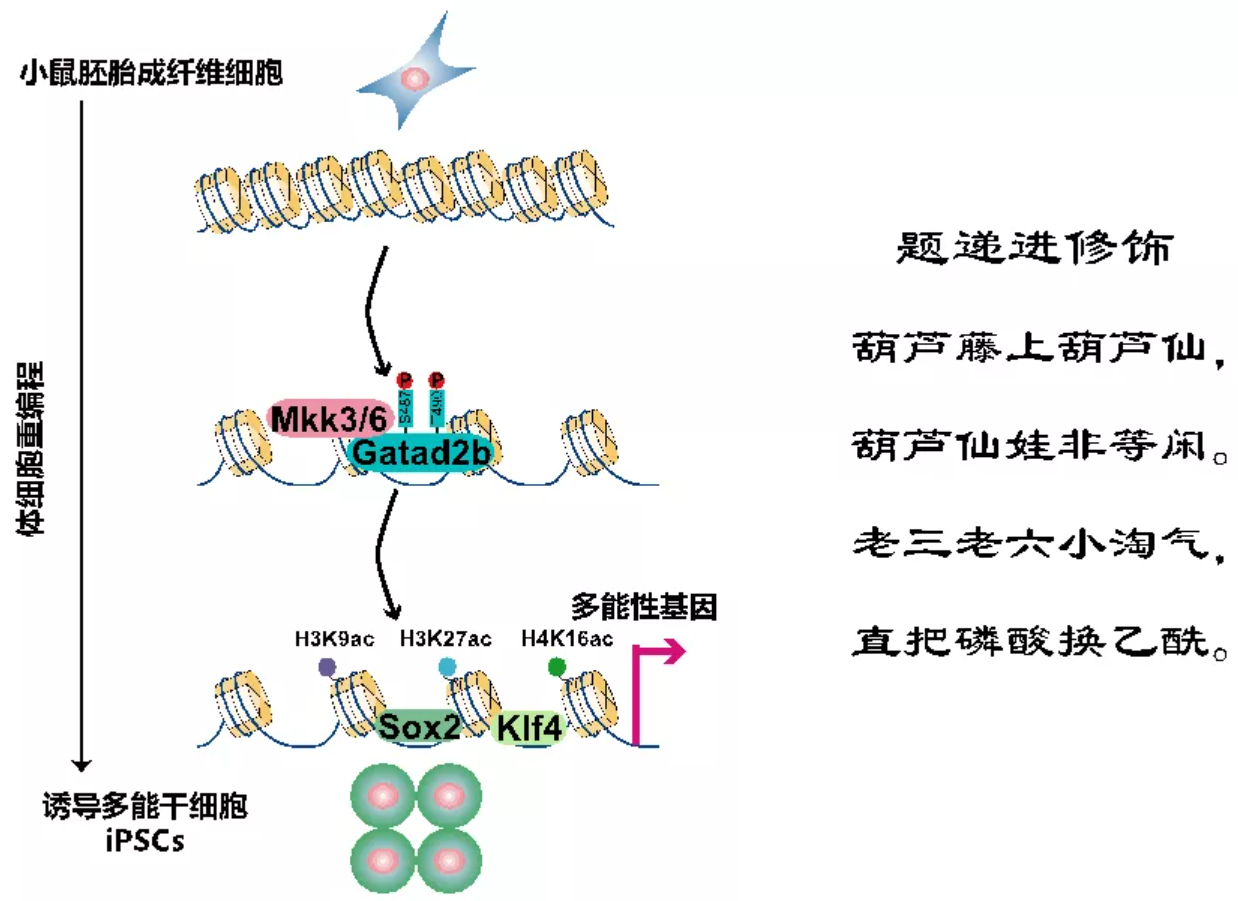
MAP2K激酶通过Gatad2b 磷酸化—组蛋白乙酰化而松散异染色质的“递进修饰”模式
原文链接:
https://www.nature.com/articles/s41418-021-00902-z
参考文献:
1. Ying Z, Chen K, Zheng L, Wu Y, Li L, Wang R, Long Q, Yang L, Guo J, Yao D, Li Y, Bao F, Xiang G, Liu J, Huang Q, Wu Z, Hutchins AP, Pei D, Liu X*, Transient activation of mitoflashes modulates Nanog at the early phase of somatic cell reprogramming, Cell Metabolism, 2016, 23(1):220-226.
2. Ying Z, Xiang G, Zheng L, Tang H, Duan L, Lin X, Zhao Q, Chen K, Wu Y, Xing G, Lv Y, Li L, Yang L, Bao F, Long Q, Zhou Y, He X, Wang Y, Gao M, Pei D, Chan W, Liu X*, Short-term mitochondrial permeability transition pore opening modulates histone lysine methylation at the early phase of somatic cell reprogramming, Cell Metabolism, 2018, 28(6):935-945.
3. Li L, Chen K, Wang T, Wu Y, Xing G, Chen M, Hao Z, Zhang C, Zhang J, Ma B, Liu Z, Yuan H, Liu Z, Long Q, Zhou Y, Qi J, Zhao D, Gao M, Pei D, Nie J, Ye D, Pan G, Liu X*, Glis1 facilitates induction of pluripotency via an epigenome–metabolome–epigenome signalling cascade, Nature Metabolism, 2020, 2(9):882-892.
4. Xing G, Liu Z, Huang L, Zhao D, Wang T, Yuan H, Wu Y, Li L, Long Q, Zhou Y, Hao Z, Liu Y, Lu J, Li S, Zhu J, Wang B, Wang J, Liu J, Chen J, Pei D*, Liu X*, Chen K*, MAP2K6 remodels chromatin and facilitates reprogramming by activating Gatad2b-phosphorylation dependent heterochromatin loosening, Cell Death & Differentiation, 2021 Nov 24 online, https://doi.org/10.1038/s41418-021-00902-z