

清华大学与中国医学科学院研究者合作解析病毒RNA与宿主蛋白质互作网络
日期:2021-11-11 浏览次数:6782
来源:结构生物学高精尖创新中心
2021年11月4日,Cell Research杂志发表了题为“基于多病毒RNA-宿主蛋白质互作组比较分析指导抗新冠肺炎的快速新药发现 (Comparison of viral RNA–host protein interactomes across pathogenic RNA viruses informs rapid antiviral drug discovery for SARS-CoV-2)”的研究文章,该研究采用高通量的ChIRP-MS技术,系统解析了不同RNA病毒,包括新冠病毒(SARS-CoV-2)、寨卡病毒(ZIKV)以及埃博拉病毒(EBOV)在侵染状态下病毒基因组RNA与宿主蛋白的互作网络 4。值得注意的是,不同于其他类似研究,该研究除了采用非感染的细胞作为对照,还引入了一类新型的实验对照–“segment transfection”。顾名思义,“segments transfection”是指将完整的基因组RNA片段化,并转染进细胞内;虽然这些RNA片段与病毒基因组的序列一致,但并不具备完整的基因组结构,也不能正常复制,可排除与病毒RNA非特异性结合的蛋白质,从而更为精确地鉴定可能直接参与病毒复制过程的宿主蛋白。
基于病毒基因组RNA-宿主蛋白互作网络,研究人员通过比较分析鉴定了一系列参与不同病毒感染的宿主蛋白质复合物(图1),比如细胞内的翻译机器(ribosome)、宿主剪切体蛋白(spliceosome)、与RNA稳定性相关的IGF2BP1-蛋白质复合物 (IGF2BP1-associated complex)、小分子核糖核酸(microRNA)代谢相关复合物(Drosha-DGCR8 complexes),以及应激小体(stress-granule)相关的蛋白质。除此外,可视化病毒RNA-宿主蛋白互作组,能够直观地发现一些病毒种类特异性的蛋白质复合物:比如SARS-CoV-2的RNA-宿主蛋白互作组特异性富集了一些三羧酸循环(TCA-cycle)以及2-氧代羧酸(2-Oxocarboxylic acid)代谢相关的蛋白质,而之前的研究也发现这两个代谢通路会因SARS-CoV-2的侵染而受到扰动。为了鉴定宿主因子在病毒感染过程中的功能,研究人员通过功能基因组手段,敲低了病毒RNA互作的多个宿主基因,并结合病毒感染实验鉴定了一系列促病毒或者抗病毒的宿主因子,在分子水平上极大促进了人们对病毒感染细胞的认识。比如,他们深入解析IGF2BP1与病毒RNA的互作机制,鉴定了IGF2BP1在病毒RNA上的结合位点,并发现IGF2BP1通过结合SARS-CoV-2以及ZIKV RNA的非编码区(UTR),从而稳定病毒RNA并促进病毒蛋白的翻译。
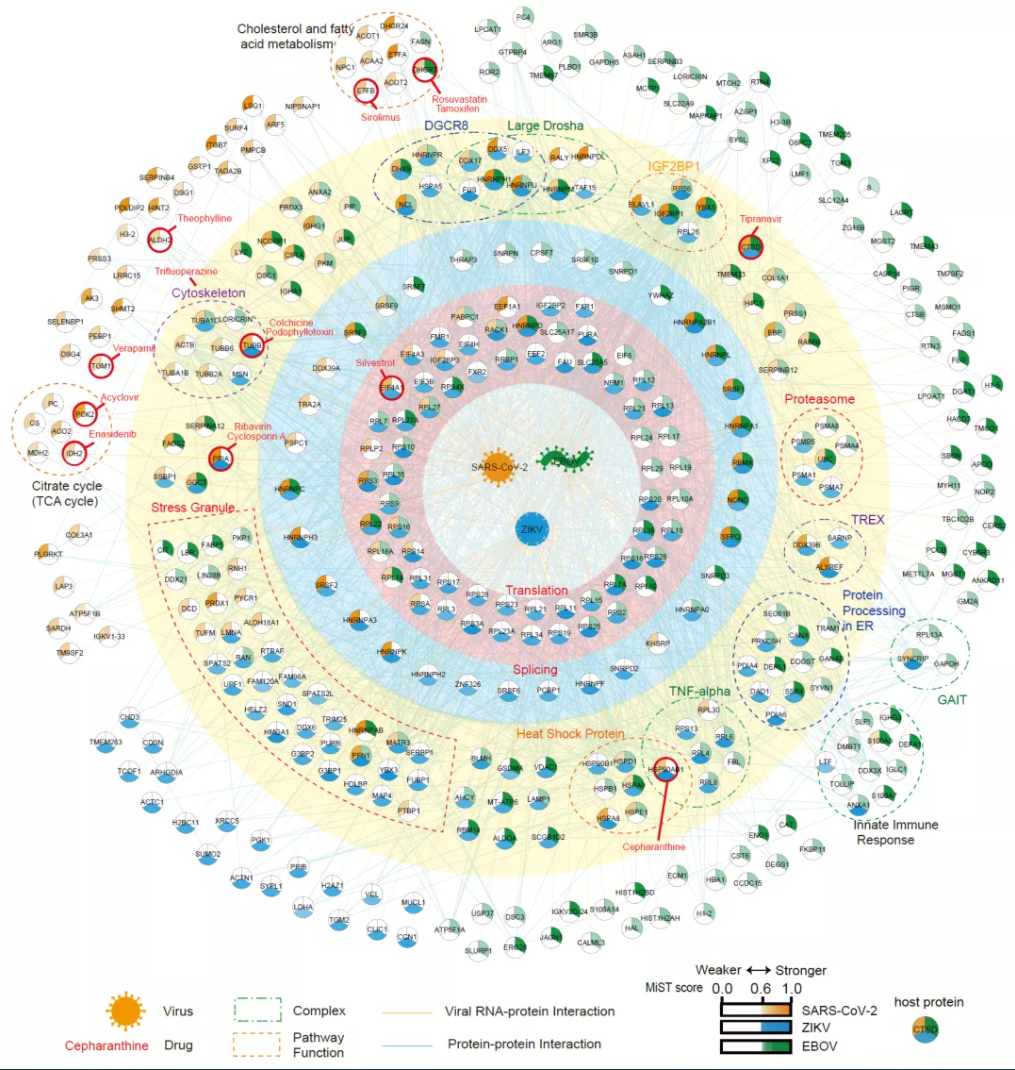
图1. SARS-CoV-2、ZIKV 和EBOV RNA与宿主蛋白互作组的比较分析
互作网路中心的节点分别代表新冠肺炎病毒(橙色)、寨卡病毒(蓝色)和埃博拉病毒(绿色)RNA。橙色连接线表示病毒RNA-宿主蛋白质的互作。蓝色连线代表宿主蛋白质-蛋白质间的互作。蛋白复合物或参与相同生物学通路的蛋白质用虚线框指示。节点的颜色由深到浅根据MiST分数标注。潜在的具有靶向药物的宿主蛋白质采用红色圆标注。
最后,利用病毒RNA-宿主蛋白质互作组数据,研究人员建立了一套从RNA互作网络出发,通过筛选靶向病毒RNA互作蛋白的临床药物,从而快速鉴定新型抗病毒药物的方法。利用这一方法,研究人员鉴定了一系列靶向SARS-CoV-2 RNA结合蛋白的药物,这些药物具有广谱抗病毒活性。在hACE2转基因小鼠模型中,研究者发现千金藤碱(Cepharanthine)和环孢菌素A(Cyclosporin A, CsA)可以有效抑制SARS-CoV-2在小鼠肺部的感染,并能减轻因感染引起的肺部炎症病变。三种靶向宿主蛋白质的药物千金藤碱、环孢菌素A和三氟吡啦嗪(Trifluoperazine),针对新冠病毒β突变株(B.1.351, 一种引发世界范围关注的SARS-CoV-2变种),依然表现出高效的抗病毒活性。除此之外,与单独用药相比,组合用药能更为有效地抑制病毒感染细胞:与溶剂组相比,千金藤碱和三氟吡啦嗪组合用药使病毒侵染率降低至万分之一。以上研究表明,靶向宿主蛋白的抗病毒药物可以有效地应对当前疫情中不断出现的病毒变种。
总之,该研究不仅绘制了不同病毒RNA-宿主蛋白质的互作组,更为重要的是研究人员通过整合这些数据,并比较不同病毒的互作组,系统地揭示了病毒在感染过程中与宿主的互作模式,为病毒学和抗病毒研究提供了重要的研究资源,并对抗病毒药物的研发提供了新的视角。
清华大学生命科学学院、结构生物学高精尖创新中心、清华-北大生命科学联合中心的张强锋副教授、中国医学科学院病原生物学研究所王健伟教授以及清华大学医学院丁强助理教授为论文共同通讯作者。清华大学生命学院博士后张少军、博士生黄文泽、中国医学科学院病原生物学研究所任丽丽研究员、清华大学医学院博士后鞠晓辉、博士生龚明丽以及中国医学科学院病原生物学研究所博士后饶健为本文共同第一作者。该研究得到清华大学蛋白质研究技术中心的大力支持,同时还得到国家自然科学基金、科技部重点研发计划、清华大学春风基金、清华-剑桥联合研究计划,以及结构生物学高精尖创新中心和清华-北大生命科学联合中心的资助。
原文链接:https://www.nature.com/articles/s41422-021-00581-y