

Protein & Cell丨松阳洲/黄军就合作揭示了Bend家族蛋白标记染色质边界并协同促进早期生殖细胞分化
日期:2021-11-10 浏览次数:5012
来源:BioArt
在哺乳动物,生殖细胞是物种进化及生命延续所必需的特殊细胞群,生殖细胞携带基因信息传递给下一代,这在生命循环中占有无可替代的地位。生殖细胞及其终末分化形成的精子和卵子均源于原始生殖细胞 (Primordial Germ Cell, PGC),因此阐明PGC的发生分化过程及其机制,对研究生殖系细胞的发育过程有着重要的意义。这不仅有助于理解个体的产生,也可以为生命的孕育及延续开辟一条新的途径。
尽管人类和小鼠生殖细胞发育存在差异,但由于研究人类发育的技术和伦理限制,体外和体内小鼠模型仍然不可或缺。事实上,对小鼠生殖细胞发育的研究已积累了丰富的信息。由于小鼠胚胎干细胞(mouse embryonic stem cell,mESCs)具有全能性、无限增殖和多向分化潜能,所以PGC可由mESCs分化而来。虽然在体外条件下能够利用胚胎干细胞诱导成PGC,进而创造出小鼠生命,但是体外诱导PGC的效率很低【1,2】。信号通路、PGC标志分子的转录水平和染色质表观遗传信息等多方面因素控制着干细胞向PGC命运转化【3-6】。探究如何提高PGC体外诱导效率,寻找和鉴定能够促进PGC产生的关键基因一直是该领域的研究热点,它既能回答生殖发育的基本科学问题,也能为干细胞的临床应用提供重要的研究基础。
2021年11月3日,中山大学生命科学学院松阳洲教授和黄军就教授课题组在Protein & Cell杂志在线发表题为Bend family proteins mark chromatin boundaries and synergistically promote early germ cell differentiation的论文。揭示了Bend家族蛋白标记染色质边界并协同促进早期生殖细胞分化,为生殖细胞分化中转录调控和染色质边界之间的相互作用提供新的见解。
核心多能性因子(OCT4、SOX2、NANOG和KLF4)在人类和小鼠PGC发育中具有重要作用【7,8】。利用多能性蛋白因子互作建立的全基因组范围的双分子荧光互补技术 (bi-molecular fluorescence complementation, BiFC)和小鼠外胚层样细胞(Epiblast like cell,EpiLC)体外诱导体系,发现了BEN家族蛋白——Bend4和Bend5,它们是序列特异性DNA结合蛋白,可以帮助标记开放和关闭的染色质的边界,并协同促进mESC向EpiLC的分化。本文表明了BEND/Bend蛋白代表了一个新的转录调节因子家族和染色质边界因子家族,参与早期生殖发育,将为生殖细胞分化中转录调控和染色质边界之间的相互作用提供新的见解。
在本研究中,以OCT4/SOX2/NANOG/KLF4为诱饵蛋白进行全基因组内18000个蛋白进行筛选,鉴定出与OCT4/SOX2/NANOG/KLF4存在相互作用的93个蛋白。再利用含有Stella-GFP报告基因的mESCs定向分化成EpiLC的系统针对93个蛋白进行了二次筛选,发现Bend5和Bend4促进胚胎干细胞定向分化成Stella阳性的外胚层类似细胞。Bend5和Bend4在PGC中高表达,作为转录因子与Oct4互作,结合到Stella上游调控区,招募DNA去甲基化酶Tet1,协同促进Stella激活。进一步,通过RNA-seq, ChIP-seq和 ATAC-seq联合分析, 发现了Bend5和Bend4 帮助标记开放和关闭的染色质的边界,协同促进mESC向EpiLC的分化(模式图)。Bend5和Bend4可能在早期PGC发育过程中协同参与标记动态染色质边界,进一步探讨这些因子的活性和机制,将为生殖细胞分化中染色质动态调控提供理论依据。
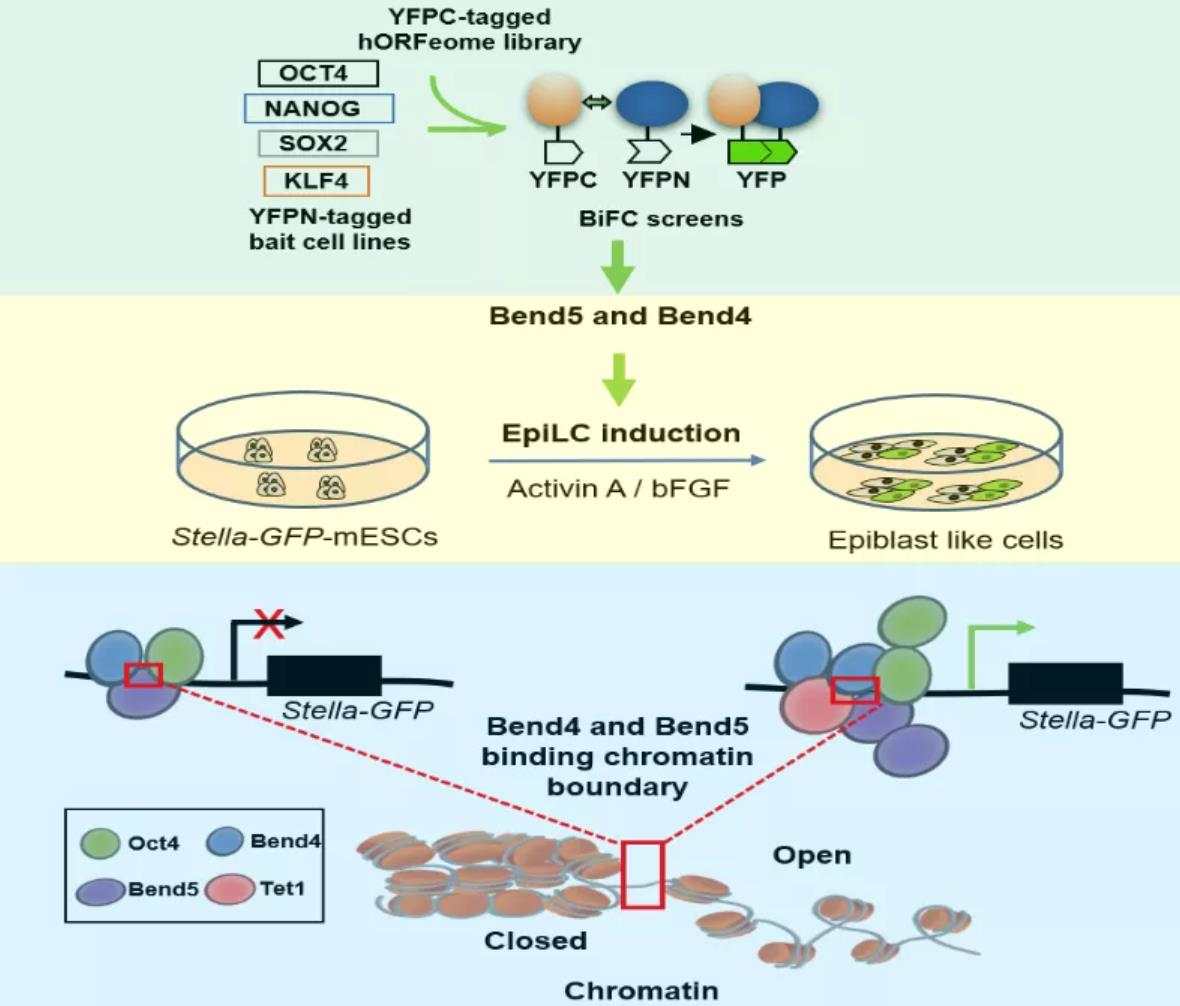
Bend5和Bend4协同促进早期生殖发育
中山大学生命科学学院时光讲师为论文的第一作者,中山大学生命科学学院黄军就教授和松阳洲教授为论文的通讯作者,中山大学生命科学学院为第一单位。
原文链接:https://doi.org/10.1007/s13238-021-00884-1