

铁蛋白纳米探针通过炎症增强的主动靶向实现肿瘤早期诊疗
日期:2021-09-06 浏览次数:9284
来源:中国科学杂志社
早发现、早治疗对于提高肿瘤患者生存率至关重要。近年来,多功能纳米探针在肿瘤诊断上展现了出色的应用潜力。但是,目前大多数的纳米探针主要是通过肿瘤血管的EPR效应被动靶向肿瘤,而依赖肿瘤血管的EPR效应只有在实体瘤形成后(此时肿瘤可能已经发生转移)才出现。因此,要想开发能够诊断治疗早期肿瘤的纳米探针,就需要寻找不依赖EPR效应的新型靶向探针。
近日,中国科学院纳米酶工程实验室阎锡蕴院士、范克龙研究员联合北京航空航天大学田捷教授在Science China Life Sciences 在线发表了题为“Ferritin nanocages for early theranostics of tumors via inflammation-enhanced active targeting”的研究论文,设计了一类基于铁蛋白的纳米诊疗探针,通过炎症增强的主动靶向实现肿瘤早期诊疗(图1)。
在肿瘤早期阶段,已有研究认为,大量炎性细胞会通过血管在肿瘤细胞附近聚集,造成肿瘤细胞附近血管内皮细胞通透性增加。该文研究也证实了这一结果,发现CD45和CD11b阳性的白细胞和髓系细胞出现在早期肿瘤细胞的周围,并且在早期肿瘤微环境中发现了红细胞和血小板作用形成的血液凝结。这些结果提示,如果将直径12nm铁蛋白纳米颗粒注射入血液中,这些纳米颗粒也能在血管渗漏过程中穿过内皮间隙进入早期肿瘤细胞的周围。由于铁蛋白特有的肿瘤主动靶向识别能力(受体TfR1在肿瘤细胞高表达),可以主动靶向识别肿瘤细胞,实现早期肿瘤成像。因此研究人员设计了一个基于铁蛋白的三模成像探针IRdye800-M-HFn,联合使用NIR-FMI/PAI/MRI三种成像模式,在人肝癌小鼠移植瘤模型上实现了肿瘤的早期成像(肿瘤接种后的第4天)。
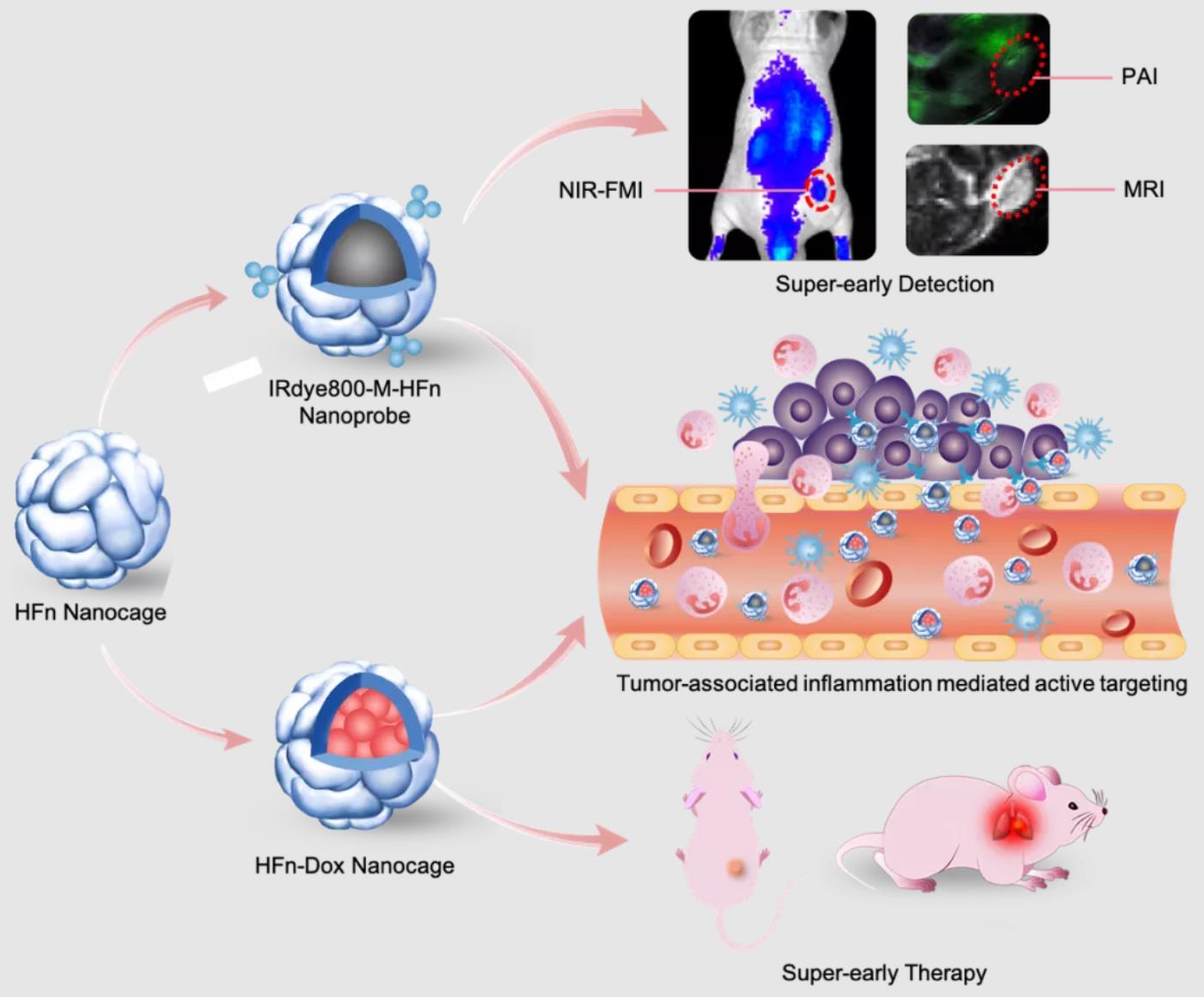
图1 铁蛋白纳米探针用于肿瘤早期诊疗
随后,研究人员在铁蛋白内腔装载了化疗药物阿霉素,合成了铁蛋白药物HFn-Dox,并在人肝癌小鼠皮下移植瘤和肺转移早期肿瘤模型中分别验证了其在肿瘤早期治疗中的效果。研究结果表明,HFn-Dox在两种肿瘤模型中均能够显著抑制早期肿瘤的发展,提高了小鼠的生存期,并表现出良好的生物安全性。
该项工作证实了铁蛋白纳米探针在肿瘤早期诊疗中的应用潜力,为后续的铁蛋白成药性研究提供了新的数据支持,并为肿瘤早期诊疗探针的设计提供了新思路。
郑州大学纳米酶医学研究中心江冰副教授、中国科学院自动化研究所贾晓花副研究员为文章共同第一作者。中国科学院纳米酶工程实验室阎锡蕴院士、范克龙研究员和北京航空航天大学田捷教授为文章通讯作者。