

Neuron | 周专课题组揭示同一囊泡中两种神经递质的不同分泌模式及其囊泡基质依赖的调控机制
日期:2019-02-20 浏览次数:7973
撰文: 王昌河
近日,北京大学分子医学研究所、麦戈文脑科学研究所、北大-清华生命科学联合中心、生物膜国家重点实验室-周专实验室,在神经科学领域权威期刊Neuron杂志上发表论文“Differential co-release of two neurotransmitters from a vesicle fusion pore in mammalian adrenal chromaffin cells1”,首次发现同一分泌囊泡中两种不同的神经递质(儿茶酚胺和ATP)按照不同的分泌模式同时释放,并揭示其囊泡基质依赖性的调控机制。
神经分泌是维持神经元与大脑功能的基础。现有研究表明,一个神经元可同时分泌几种不同的神经递质对下一级神经元进行调控,这种神经递质的共分泌现象在神经和内分泌细胞中普遍存在,但这些递质是否来自同一个分泌囊泡(~100 nm)尚存在争议,同时共分泌的神经递质是否存在不同的调节模式也不清楚。
为研究同一囊泡中两种神经递质共分泌的调控机制,周专实验室以神经内分泌细胞(肾上腺嗜铬细胞)为模型,采用7 μm直径碳纤维电极(CFE)和sniffer patch双电极联合记录的方法,对儿茶酚胺(Catecholamine,CA)和ATP两种递质的“量子化”分泌进行同步测定。研究结果首次提供直接证据,证明CA和ATP的确共存于同一分泌囊泡,并且它们在同一囊泡中进行同步释放(图1)。
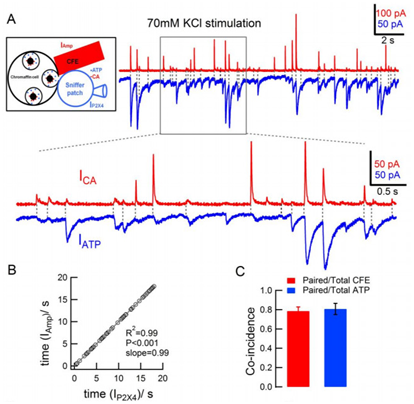
图1. CA与ATP量子化分泌的同步记录
神经递质可以通过囊泡与质膜的全融合(full fusion)进行全或无(all-or-none)的“量子化”分泌。自周专教授1996年采用高敏微碳纤电极首次记录到”亚量子化” (sub-quantal)分泌模式以来,人们逐渐发现,分泌囊泡还可与细胞膜进行瞬间融合,神经递质通过融合孔进行部分释放(释放水平受融合孔开放大小与开放时间调控)。随后融合孔快速关闭,囊泡从细胞膜上分离下来进行酸化和循环再利用,这种分泌模式被称之为kiss-and-run。为进一步研究两种递质的“量子化”释放规律,作者通过SOM (somatostatin)处理和Syt7(synaptotagmin 7)基因敲除等方式缩小囊泡融合孔。他们惊奇地发现,两种处理均可降低同一个囊泡中CA的“量子化”水平,而对ATP分泌没有影响,表明同一囊泡中的两种神经递质在以不同的分泌模式进行释放: ATP以全或无(all-or-none)的“量子化”方式进行释放,其单个囊泡的量子化水平几乎不受囊泡融合孔开放大小影响,而CA则以“亚量子化”分泌模式进行释放,其“量子化”水平与囊泡融合孔开放大小密切相关。
分泌囊泡分为清澈小囊泡(SVs, small clear vesicles)和致密核心大囊泡(LDCVs, large dense-core vesicles),肾上腺嗜铬细胞中只含有LDCVs。两种囊泡除大小不同外,主要的区别是LDCVs中填充着大量的囊泡基质。ATP在SVs和LDCVs中均有分布,而CA则只存在于LDCVs中,且被囊泡基质(matrix)包裹。由此,作者进一步分析了囊泡基质蛋白对CA和ATP分泌的影响。他们发现敲低(Knockdown)或敲除(Knockout) LDCVs中的matrix蛋白CgA(Chromogranin A,嗜铬蛋白A)后,SOM对CA的“量子化”水平的调节作用消失,表明囊泡的matrix是囊泡分泌模式之外的另一个独立的分泌调控机制,是在kiss-and-run分泌模式下决定神经递质“量子化”释放水平的关键。在kiss-and-run分泌模式下,因CA被matrix包裹,囊泡融合孔开放大小通过影响matrix溶解速度来调控CA的解离与释放水平;相反,不被matrix包裹的ATP可自由通过囊泡融合孔,其释放水平受融合孔影响较小,主要以全释放模式进行分泌(图2)。
综上,该研究确认了神经内分泌细胞中同一个致密囊泡中CA和ATP的共分泌现象,进一步发现CA和ATP共分泌存在着不同的分泌模式,而且囊泡matrix作为一种独立的调控手段,与囊泡分泌模式共同作用调节CA和ATP的共分泌水平,致密囊泡内matrix是决定囊泡内不同递质是否发生亚量子化分泌(sub-quantal)的决定因子。该研究为进一步认识神经元的突触囊泡内递质分泌机制起到了很好的指引作用。
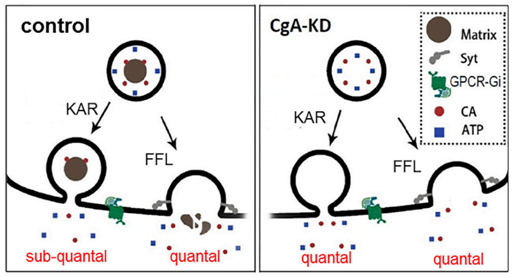
图2. CA与ATP量子化分泌水平调控机制模式图
值得一提的是, 周专于1995年发明了低噪音的电化学微电极ProCFE(J Bio Chem, 1996)。应用ProCFE,周专小组在细胞神经递质“量子化”分泌的研究与发展中做出了一系列重要贡献,包括在肾上腺内分泌ACC细胞致密囊泡(DVC)上首次记录到神经递质的“亚量子化”分泌(Biophys J, 1996);发现首个DVC亚量子分泌调控蛋白(Nat Neurosci, 2005);发现局部钙信号对亚量子化分泌的调控作用与机制(Sci Signal,2017);在神经元突触和胞体分别记录到单胺类“量子化”分泌(PNAS, 1995; 2008);以及近期报道的所有DVC都是经过亚量子分泌,而不是1950年以来教科书所写的“量子化”分泌(J Neurosci, 2019)。本次研究1揭示DVC亚量子分泌分子原理的一个重要推理是,与神经DCV亚量子分泌模式不同,突触清亮囊泡分泌模式全都是量子化的(Neuron, 2019)。
文章链接:https://www.cell.com/neuron/fulltext/S0896-6273(19)30058-3?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS0896627319300583%3Fshowall%3Dtrue