

杨薇院士发现的DNA聚合酶机理揭示催化新世界
日期:2017-04-26 浏览次数:9006
北京大学生命科学学院苏晓东、廉腾飞供稿2017年4月14日(星期五),国际著名生物化学及结构生物学家,美国科学院院士、美国国立卫生研究院(NIH)资深研究员杨薇教授应邀到北京大学生命科学学院访问,并作了题为“DNA translesion synthesis and a new paradigm for enzyme catalysis”的报告,随后参观访问了北京大学BIOPIC(生物光学动态成像中心),杨薇院士的报告由中国晶体学会理事长及北大BIOPIC常务副主任、中国生物物理学会单分子专业分会理事长苏晓东教授主持。

长期以来,人们(教科书)认为酶催化的反应主要需要由蛋白质-底物之间的特异相互作用集中排列好底物和酶就可以了,就像DNA的合成只需要DNA双链(需要打开其中一个单链作为模板)、dNTP、DNA聚合酶以及两个镁离子(中和核酸及核苷酸电性)的存在即可。但是,杨薇教授近年来通过传统的时间分辨(time-resolved) X-射线晶体学方法证明,在传统认为的只有两个镁离子存在的时候,DNA聚合反应并不能发生。(详见Gao, Y. & Yang, W. (2016) Capture of a third Mg2+ is essential for catalyzing DNA synthesis, Science, 352, 1334-1337.以及综述文章A new paradigm of DNA synthesis: three-metal-ion catalysis.Yang W, Weng PJ, Gao Y.Cell Biosci. 2016 Sep 6;6(1):51. doi: 10.1186/s13578-016-0118-2. eCollection 2016. Review.)
他们首先将一个杨薇实验室已经研究了很多年的反应比较慢的低保真度DNA聚合酶Pol η与底物DNA和dATP进行共结晶,为避免催化反应的发生,他们使用钙离子来代替镁离子并利用使反应更加缓慢进行的低pH(pH6.0)缓冲液,然后,他们把共结晶生长的晶体转移到适合发生反应的缓冲液中(pH7.0并含有镁离子),浸泡不同的时间,让DNA的聚合反应在晶体中缓慢进行。杨薇院士提到其实早在1926年,康奈尔大学的James B. Sumner教授就证明过脲酶以晶体形式存在时,仍然可以催化生化反应的进行,生成可以嗅到的尿素。通过解析在反应缓冲液中浸泡了不同时间段的各个复合物晶体的高分辨结构,她们发现随着浸泡时间的延长,底物的构象发生了改变以适应反应的进行,而且底物核苷酸一侧的两个镁离子也能够看得比较清楚,然而随着时间的推移,在活性中心的另外一边(产物形成的一侧)逐渐出现了一块新的电子云密度,比较合理的显示着第三个金属离子的出现,但是由于镁离子衍射X射线的能力较弱,电子云密度不够强,是否有第三个离子的存在还不能据此得到确凿的结论。
他们后来想到更好的办法,即使用比镁离子重并且异常散射信号强的锰离子来代替镁离子重复该实验,锰离子同样也能促使该反应的发生,而且对于X射线的衍射能力很强,容易得到明确无误的电子密度图。下图就是利用锰离子的反应,显示了随着浸泡时间的延长,反应中心的构象随之变化的情况,其中第三个锰离子的密度清晰可见,而且把体系中锰离子的浓度降低到远小于解离常数值的时候,反应并不会发生,第三个锰离子的密度也看不见,进一步证明了该结论的正确性。
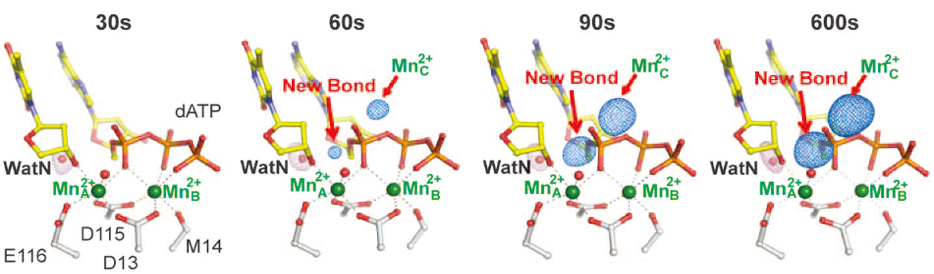
除了“眼见为实”的蛋白质晶体结构分析,杨薇他们还进行了非常精密的生物化学反应实验,特别是在“晶体内”进行三个金属离子的结合力测定,发现已知的两个金属离子结合位点(MnA和MnB)具有较强的结合(解离常数约为0.5 微摩尔),而第三个金属离子的结合较弱,解离常数只有约为2.7 微摩尔,结合减弱5倍多。然而,这“第三个金属离子”确实为反应顺利进行所必须,而不仅仅是结合离去产物的离子。
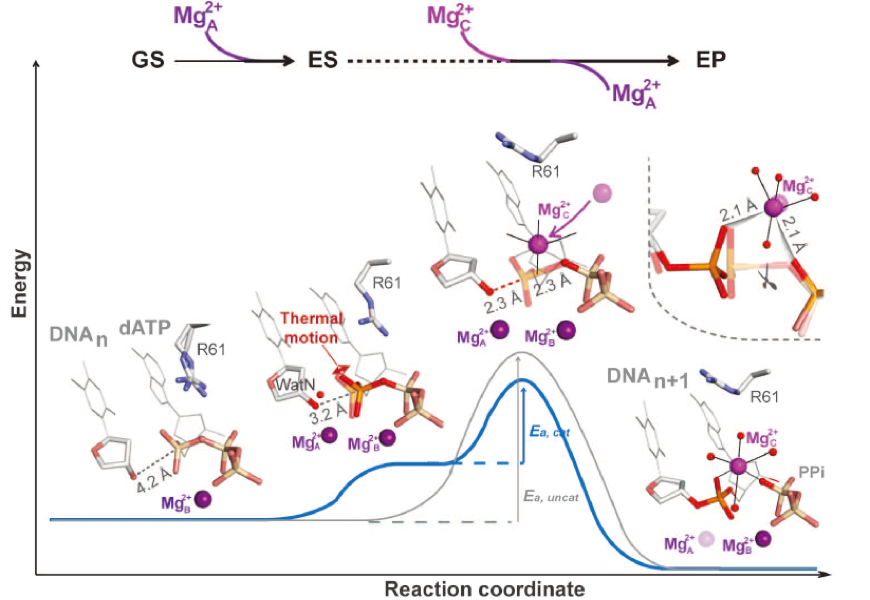
根据这些结果,杨薇教授提出了新的酶促反应的机理(见下图),传统生化观点认为酶会和底物(包括各种所需底物分子及镁离子)结合并进而形成降低反应自由能的中间态,达到这种稳定的中间态结构以后,反应基本可以在热运动(也可以理解为布朗运动)能量的推动下顺利向产物方向进行,这一观点也许适用于比较简单的酶促反应体系,对于DNA或者RNA聚合酶这样的复杂体系并不完全正确。除了降低反应自由能的中间态(下图蓝线前半部分),还可以有“第三个金属离子”作为辅助手段来帮助推动下半部分反应的进行。就像“撑杆跳高”,借助于“一根杆子”这样的辅助工具,可以跳过更高的反应能(下图蓝线的后半部分)。
“第三个金属离子”作为辅助手段参与生化反应可能具有普遍的意义,不仅仅适用于DNA或者RNA聚合酶系统,还可能在核苷酸及磷酸参与反应的众多生化体系中广泛存在,这个新的酶促机理对于深入理解酶的反应机理细节,基于结构的药物(酶的小分子抑制剂)设计以及计算生物化学具有深远的意义。
杨薇老师在4月14日下午还在北京大学BIOPIC(生物光学动态成像中心)进行了参观访问,并且与相关的老师和同学们进行了座谈,了解了BIOPIC的发展方向及所取得的科研成果,与在RNA 聚合酶的计算方向的研究组同仁及北京大学的晶体学方向的同学老师进行了广泛深入的交流。
